センター試験の化学Ⅰの演習問題を紹介しています。このページは,ダニエル電池の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | ダニエル電池 |
|---|---|
| 年度 | 2014年度 |
| 問題番号 | 化学Ⅰ-第2問-問6 |
| 配点 | 4 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
⑤ 0.032g増加する。
スポンサーリンク
解説
ダニエル電池の基本的な問題です。
電池や電気分解の計算問題では,流れた電子e-の物質量〔mol〕が中心になります。問題を解く過程は以下の通りです。
- 電流〔A〕と通電時間〔秒〕から,流れた電気量〔C〕を求める。
- 流れた電気量〔C〕とファラデー定数〔C/mol〕から,流れた電子e-の物質量〔mol〕を求める。
- 銅電極での化学反応式を書き,係数比から,反応した銅Cuの物質量〔mol〕を求める。
- 銅Cuの物質量〔mol〕と原子量から,変化した質量〔g〕を求める。
実際の数値を当てはめて,次のように求めることができます。
- 0.5A×193秒=96.5C
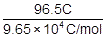 =0.0010mol
=0.0010mol- Cu2+ + 2e- → Cu より,流れた電子e-の
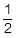 倍の物質量〔mol〕の銅Cuが析出する。
倍の物質量〔mol〕の銅Cuが析出する。
0.0010mol×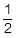 =0.00050mol
=0.00050mol - 0.00050mol×64g/mol=0.032g
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |