「原子の構造」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 原子の構造と性質 > 原子の構造
原子の存在
1802年,イギリスのドルトンが「物質は,それ以上分割することができない粒子からできている」という考えを提唱しました。この考えを原子説といい,物質を構成する最小の粒子を原子とよんでいます。
原子は,直径10-10m程度の大きさをもっています。実際は,原子を構成するさらに小さい粒子(素粒子)が存在しており,その素粒子の種類と数によって原子の種類が決まります。
原子よりも小さい素粒子が存在しているのは確かですが,通常の化学反応では原子の種類は変化しません。そのため,高校で学習する内容では,物質の最小単位を原子と考えるのです。
原子の構造
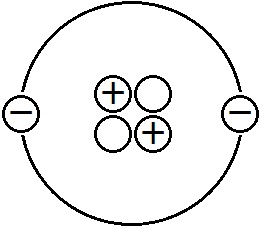
基本的に,原子は「陽子」,「中性子」,「電子」の3種類の素粒子でできています。右図のように,原子の中心に陽子(+)と中性子(○)が集まっており,その周囲を電子(-)が取り巻いています。中心の陽子と中性子のまとまりを「原子核」といいます。
これらの素粒子の重要な特徴の1つとして,電気的な性質があります。陽子はプラスの電気(正電荷)をもっており,電子はマイナスの電気(負電荷)をもっています。その絶対値は等しいため,陽子と電子1個ずつでお互いの電荷を打ち消し合います。通常の原子は陽子と電子を同じ数だけもっているので,電荷は±0の状態(電気的に中性)です。ちなみに,中性子は電荷をもっていません。
特に覚える必要はありませんが,陽子1個当たりの電気量は+1.602×10-19Cです。もちろん,電子1個当たりの電気量は-1.602×10-19Cです。電気量は,1A(アンペア)の電流が1秒間流れたときに1C(クーロン)と定義されています。
おまけ話
ふつう,正電荷と正電荷は反発し合います。そのため,原子核の中の陽子は互いに反発するはずです。それなのに,中心で複数の陽子がまとまっているのはナゼなのでしょうか。
この謎を解明するために,1935年,日本の湯川秀樹は中間子説を唱えました。
陽子には,正電荷の正体である「中間子」というものが存在しています。陽子が中性子に「中間子」を渡すと,陽子は正電荷を失って中性子に,中性子は正電荷を受け取って陽子へと変化します。
この中間子の受け渡しが,陽子どうしが反発する間もなく起こるので,原子の中心にまとまっていられるというのです。
実際に,陽子を2個以上もつ原子には,必ず中性子が存在しています。
スポンサーリンク
原子番号
原子の化学的な性質は,電子の数によって決まります。原子の状態では,電子数と陽子数が等しいので,陽子の数によって原子の種類が決まるともいえます。
陽子の数によって元素の種類が決まるので,陽子数を「原子番号」とよんでいます。つまり,「原子番号=陽子数=原子状態での電子数」です。このことにより,原子番号1は陽子を1個もつ水素Hであるというように,元素ごとに固有の番号となるのです。
省略されることも多いのですが,原子番号を表記する場合は元素記号の左下に書くことになっています。
例 : 1H ,6C
原子番号,つまり陽子数は,この後かなり重要になります。原子番号20までの元素は確実に覚えておきましょう。
1H 2He 3Li 4Be 5B 6C 7N 8O 9F 10Ne 11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar 19K 20Ca
水 兵 リーベ ぼ く の お船 七曲がり シップス クラーク か
スポンサーリンク