「溶液の濃度」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 物質量と化学反応式 > 溶液の濃度
物質の溶解
食塩を水に加えてかき混ぜると,全体が均一な液体になります。このような現象を溶解といいます。
このとき,食塩水のような均一になった液体を溶液といいます。また、水のように他の物質を溶かしている液体を溶媒、食塩のように溶媒に溶けた物質を溶質といいます。溶媒が水である溶液を,特に水溶液とよんでいます。
ただ,あまり多くの食塩を加えた場合は,すべての食塩が溶解するわけではありません。一部の食塩が溶け残ってしまいます。また,溶媒の水を蒸発させるなどすると溶けきれなくなった食塩が析出してきます。このとき,上澄みの溶液には,さらに食塩を溶かすことができません。このような溶液を飽和溶液といいます。
100gの溶媒に溶かすことのできる溶質の質量〔g〕を,溶解度といいます。100gの溶媒に溶解度の分だけ溶質を溶かすと,飽和溶液になります。一般に,イオン結晶や極性分子は,同じく極性をもつ水などの極性溶媒に溶けやすい傾向があります。逆に,極性をもたないヨウ素I2などは,同じく極性をもたないヘキサンC6H14などの無極性溶媒に溶けやすい傾向があります。
また,固体の溶質は温度が高いほど溶解度が大きくなり,気体の溶質は温度が高いほど溶解度が小さくなる傾向があります。例外としては,水酸化カルシウムCa(OH)2があります。水酸化カルシウムは固体ですが,温度が高いほど水に溶けにくくなります。ちなみに,水酸化カルシウムの飽和水溶液が石灰水です。
質量パーセント濃度
質量パーセント濃度は,溶液全体の質量に対して,注目する溶質の質量がどのくらいの割合なのかを示す値です。
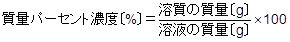
例えば,190gの水に10gの食塩を溶かした水溶液の質量パーセント濃度は,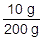 ×100=5%です。
×100=5%です。
溶質が2種類あっても,関係ありません。水80gに砂糖15gと食塩5gを溶かした水溶液について,
砂糖の質量パーセント濃度は,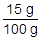 ×100=15%です。
×100=15%です。
食塩の質量パーセント濃度は,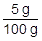 ×100=5%です。
×100=5%です。
また,「質量パーセント濃度〔%〕」,「溶液の質量〔g〕」,「溶質の質量〔g〕」のうち,2つの値がわかっていれば,方程式を解いて残りの1つを求めることができます。
モル濃度
モル濃度は,溶液1Lあたりに溶けている溶質の物質量〔mol〕を表す濃度で,モル濃度の単位は〔mol/L〕です。
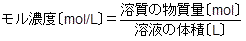
例えば,0.30molの水酸化ナトリウムを水に溶かして0.50Lとした水溶液のモル濃度は,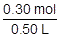 =0.60 mol/Lです。
=0.60 mol/Lです。
また,「モル濃度〔mol/L〕」,「溶液の体積〔L〕」,「溶質の物質量〔mol〕」のうち,2つの値がわかっていれば,方程式を解いて残りの1つを求めることができます。
ちなみに,単位を確認すれば計算式は見えてきます。「 / 」(スラッシュ)は分数であることを表しているので,mol/Lは 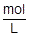 を意味します。つまり,モル濃度〔mol/L〕を求めるためには,「mol」の単位で表される物質量を,「L」の単位で表される体積で割ればいいことがわかります。
を意味します。つまり,モル濃度〔mol/L〕を求めるためには,「mol」の単位で表される物質量を,「L」の単位で表される体積で割ればいいことがわかります。
この考え方は,すべての計算に当てはまります(密度の「g/cm3」など)。
スポンサーリンク
水溶液の調製
ある濃度を目指して水溶液をつくることを「調製」といいます。
高校の化学ではモル濃度がよく用いられますので、正確なモル濃度の水溶液を調製する手順を知っておく必要があります。
モル濃度は,「溶液1Lあたりに溶けている溶質の物質量〔mol〕を表す濃度」です。水1Lに何かを溶かすと,その水溶液は1Lではなくなってしまうので注意してください。あくまで,水溶液になったときの体積で「1Lあたり」なのです。
例えば,0.100mol/Lの塩化ナトリウム水溶液を100mL(0.100L)つくるとします。このとき,塩化ナトリウムは0.100mol/L×0.100L=0.0100molが必要です。また,NaClの式量は23+35.5=58.5なので,0.0100mol×58.5g/mol=0.585gの塩化ナトリウムを量り取ります。
量り取った塩化ナトリウムをビーカーに入れ,少量の水に溶かします。あとで水を加えながら100mLにするので,そのときに100mLを超えてしまわないようにしなければいけません。
少量の水に溶かしてできた水溶液を,100mLのメスフラスコに移します。このとき,ビーカーやガラス棒に付着している水溶液も少量の水で洗ってメスフラスコに移します。これらの水溶液にも塩化ナトリウム0.0100molの一部が含まれているからです。
 メスフラスコの標線まで水を加えると100mLになります。このとき,水溶液の表面が曲面になる(メニスカス)ので,その一番低いところを標線に合わせます。
メスフラスコの標線まで水を加えると100mLになります。このとき,水溶液の表面が曲面になる(メニスカス)ので,その一番低いところを標線に合わせます。
メスフラスコをよく振って均一の水溶液にすると,0.100mol/Lの塩化ナトリウム水溶液の完成です。
詳しい手順や写真つきの説明は,実験のページをご覧ください。
スポンサーリンク