「酸・塩基の分類」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸と塩基の反応 > 酸・塩基の分類
酸・塩基の価数
塩化水素HClや硫酸H2SO4を水に溶かすと,次のように電離して水素イオンH+を生じます。
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
このとき,化学反応式と量的関係を考えると,1molの塩化水素HClが電離すると1molの水素イオンH+が生じます。また,1molの硫酸H2SO4が電離すると2molの水素イオンH+が生じます。
塩化水素HClのように1molの酸から1molの水素イオンH+を生じるものを1価の酸といいます。また,硫酸H2SO4のように1molの酸から2molの水素イオンH+を生じるものを2価の酸といいます。
気を付けたいのが,酸に含まれる水素原子がすべて水素イオンH+になるとは限らないということです。例えば,酢酸CH3COOHは次のように電離します。
CH3COOH → CH3COO- + H+
1molの酸から1molの水素イオンH+しか生じませんので,酢酸CH3COOHは1価の酸です。水素原子が4つあるから「4価の酸」とするのは誤りです。
塩基の価数についても同様に考えることができます。水酸化ナトリウムNaOHや水酸化カルシウムCa(OH)2は次のように電離します。
NaOH → Na+ + OH-
Ca(OH)2 → Ca2+ + 2OH-
1molの塩基から生じる水酸化物イオンOH-の物質量〔mol〕が塩基の価数となるので,水酸化ナトリウムNaOHは1価の塩基,水酸化カルシウムCa(OH)2は2価の塩基です。
アンモニアNH3は,分子内に水酸化物イオンOH-を含んでいません。しかし,アレニウスの定義で考えると,水に溶かしたとき,次のように水H2Oと反応して水酸化物イオンOH-を生じます。
NH3 + H2O  NH4+ + OH-
NH4+ + OH-
よって,アンモニアNH3は1価の塩基です。
また,ブレンステッドの定義で考えても,1molのアンモニアNH3は1molのH+を受け取るので,1価の塩基と考えることができます。
NH3 + H+ → NH4+
表 主な酸・塩基の価数
| 物質名 | 化学式 | 分類 |
|---|---|---|
| フッ化水素 | HF | 1価の酸 |
| 塩化水素 | HCl | |
| 臭化水素 | HBr | |
| ヨウ化水素 | HI | |
| 硝酸 | HNO3 | |
| 酢酸 | CH3COOH | |
| 硫酸 | H2SO4 | 2価の酸 |
| シュウ酸 | (COOH)2 | |
| 二酸化炭素 | CO2 | |
| 硫化水素 | H2S | |
| リン酸 | H3PO4 | 3価の酸 |
| 水酸化ナトリウム | NaOH | 1価の塩基 |
| 水酸化カリウム | KOH | |
| アンモニア | NH3 | |
| 水酸化カルシウム | Ca(OH)2 | 2価の塩基 |
| 水酸化バリウム | Ba(OH)2 | |
| 水酸化マグネシウム | Mg(OH)2 | |
| 水酸化鉄(Ⅱ) | Fe(OH)2 | |
| 水酸化銅(Ⅱ) | Cu(OH)2 | |
| 水酸化アルミニウム | Al(OH)3 | 3価の塩基 |
| 水酸化鉄(Ⅲ) | Fe(OH)3 |
スポンサーリンク
電離度
塩化水素HClと酢酸CH3COOHは,どちらも1価の酸です。しかし,同じモル濃度の塩酸と酢酸では,酸としての反応の程度が違います。例えば,同じモル濃度の塩酸と酢酸に亜鉛を入れると,塩酸の方が激しく水素を発生しながら溶けていきます。
これは,酸性を示す原因である「水素イオンH+」のモル濃度が違うために生まれる差です。つまり,酢酸の方はあまり電離しておらず,水素イオンH+が少ないということがわかります。
そこで,どの程度の割合で電離しているのかを表したものが電離度です。電離度を表す記号としてはα(アルファ)が用いられ,「まったく電離していない場合の物質量〔mol〕」に対する「電離した物質量〔mol〕」の割合を計算して求めます。

たとえば,1molのアンモニアを水に溶かしたときに,OH-が0.01mol生じたとします。このときの量的関係は,次のようになります。
| NH3 | + | H2O | → | NH4+ | + | OH- | |
| 電離前〔mol〕 | 1 | たくさん | 0 | ほぼ0 | |||
| 変化量〔mol〕 | -0.01 | -0.01 | +0.01 | +0.01 | |||
| 電離後〔mol〕 | 0.99 | たくさん | 0.01 | 0.01 |
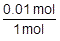 =0.01 です。
ちなみに,電離度は温度や濃度によって変化します。一般的に,濃度が高くなると電離しにくくなり,電離度は小さな値になります。逆に,希薄溶液では電離度が高くなります。
=0.01 です。
ちなみに,電離度は温度や濃度によって変化します。一般的に,濃度が高くなると電離しにくくなり,電離度は小さな値になります。逆に,希薄溶液では電離度が高くなります。
酸・塩基の強弱
同じ温度や濃度の水溶液でも,溶質の種類が違うと電離度も異なる値になります。
塩化水素や水酸化ナトリウムなどは,濃度が高くても非常に大きな電離を示します。一方,酢酸やアンモニアなどは,電離度は小さい傾向があります。
塩化水素のように,水溶液中でほぼすべて電離する酸を,強酸といいます。同様に,水溶液中でほぼすべて電離する塩基を,強塩基といいます。
一方,酢酸のように,水溶液中であまり電離しない酸や塩基を,弱酸や弱塩基といいます。
高校における化学基礎・化学で出てくる酸・塩基では,強酸・強塩基の方が圧倒的に少ないので,強酸・強塩基を暗記してしまい,それ以外は弱酸・弱塩基と判断することができます。
| 強酸 | 塩化水素HCl,臭化水素HBr,ヨウ化水素HI,硝酸HNO3,硫酸H2SO4 (ハロゲン化水素のうち,フッ化水素HFだけは弱酸) |
| 強塩基 | アルカリ金属元素の水酸化物,アルカリ土類金属元素の水酸化物 *よく出てくる強塩基は,次の4つ。 水酸化ナトリウムNaOH,水酸化カリウムKOH, 水酸化カルシウムCa(OH)2,水酸化バリウムBa(OH)2 |
スポンサーリンク