「弱酸・弱塩基の遊離」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸と塩基の反応 > 弱酸・弱塩基の遊離
弱酸の遊離
遊離とは「化合物中の結合が切れて、原子または原子団が分離すること」という意味をもつ単語ですが,「元の物質が生じること」という意味だと考えて構いません。
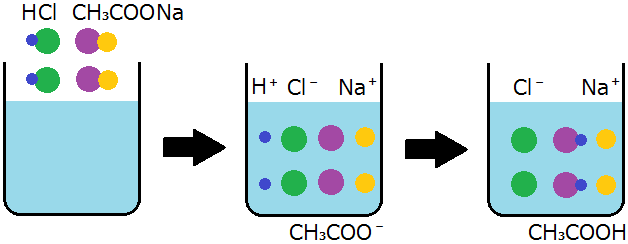
例えば,酢酸ナトリウムの水溶液に塩酸を加えると,酢のにおいが強くなります。これは,酢酸イオンCH3COO-が元の酢酸CH3COOHとなったことが原因です。このとき,「酢酸が遊離した」といいます。
弱酸の遊離は,酸の強弱で考えることができます。加水分解のページで,弱酸はイオンや塩として存在しにくいことを説明しました。逆に,強酸はイオンや塩として存在しやすい物質です。
酢酸ナトリウムは水溶液中ではほぼすべてが電離して,酢酸イオンとナトリウムイオンを生じています。
CH3COONa → CH3COO- + Na+
ここに塩酸を加えると,さらに水素イオンと塩化物イオンが共存することになります。
HCl → H+ + Cl-
陽イオンと陰イオンの組合せがいくつか考えられますが,電離しやすい物質が生じるような反応はほとんど起こりません。イオンや塩として存在しにくい物質が生じます。ここでは,弱酸である酢酸が生じることになるのです。これが弱酸の遊離です。
その結果,ナトリウムイオンや塩化物イオンは電離したまま水溶液中に存在していますが,イオン反応式ではなく次のような化学反応式で表すことが多いです。
CH3COONa + HCl → CH3COOH + NaCl
スポンサーリンク
弱塩基の遊離
弱酸の遊離と同様の現象が,弱塩基についても起こります。
塩化アンモニウムは電離してアンモニウムイオンと塩化物イオンを生じます。
NH4Cl → NH4+ + Cl-
ここに水酸化ナトリウムなどの強塩基を加えると,さらにナトリウムイオンと水酸化物イオンが共存することになります。
NaOH → Na+ + OH-
ここで,アンモニウムイオンと水酸化物イオンが反応して,弱塩基のアンモニアが遊離します。
NH4+ + OH- → NH3 + H2O
全体の反応を化学反応式で表すと,次のようになります。ただし,塩化ナトリウムは,水溶液中でナトリウムイオンNa+,塩化物イオンCl-として存在しています。
NH4Cl + NaOH → NH3 + H2O + NaCl
気体が発生する反応
弱酸・弱塩基の遊離は,アンモニアなどの気体の製法として利用されることが多くあります。
例えば,炭酸カルシウムCaCO3に希塩酸HClを加えることで,弱酸である炭酸H2CO3が遊離します。さらに,炭酸が分解して二酸化炭素CO2が生じます。
CaCO3 + 2HCl → CaCl2 + H2O + CO2
この反応は,酸性塩の炭酸水素ナトリウムなどを用いることもできます。
2NaHCO3 + 2HCl → 2NaCl + 2H2O + 2CO2
先ほど炭酸が遊離すると書きましたが,ここで反応が止まるような書き方はしません。H2CO3と書かずに,必ずH2O+CO2と書くように気を付けましょう。
また,亜硫酸ナトリウムNa2SO3に希硫酸H2SO4を加えることで,弱酸である亜硫酸H2SO3が遊離します。さらに,亜硫酸が分解して二酸化硫黄SO2が生じます。
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
この反応は,酸性塩の亜硫酸水素ナトリウムNaHSO3を用いることもできます。
2NaHSO3 + H2SO4 → Na2SO4 + 2H2O + 2SO2
硫酸H2SO4と亜硫酸H2SO3はよく似ていますが,硫酸は強酸,亜硫酸は弱酸です。酸・塩基の分類で紹介したように,強酸・強塩基を暗記してしまい,それ以外は弱酸・弱塩基と判断してください。
スポンサーリンク