「酸化数」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸化還元反応 > 酸化数
酸化数の増減による酸化・還元の定義
前のページで,電子の授受による酸化・還元の定義を紹介しました。酸素原子や水素原子がかかわらない反応についても酸化・還元の判断をすることができるので,高校で学習するものの中では最も有効な定義だと言えます。
ただし,イオン結晶のように電子の移動がはっきりしている場合はいいのですが,共有結合がかかわるような分子からなる物質の場合は判断が難しくなります。
そこで,原子のもつ電荷を,酸化・還元の指標として酸化数とよんでいます。そして,反応によって酸化数が増加すると酸化された,酸化数が減少すると還元されたと判断します。
スポンサーリンク
酸化数の求め方
酸化数は,次のように求めることができます。
- 単体中の原子の酸化数は0(ゼロ)
例:H2中のHの酸化数は0,Cu中のCuの酸化数は0 - 化合物やイオンに含まれる水素原子の酸化数は+1,酸素原子の酸化数は-2
例:CO2中のOの酸化数は-2,HSO4-中のHの酸化数は+1 - 化合物中の酸化数の総和は0(ゼロ)
例:H2SO4について,Sの酸化数をxとおくと,+1×2 + x +(-2)×4 = 0
よって,x=+6 - イオン中の酸化数の総和は,その電荷
例:HPO42-について,Pの酸化数をxとおくと,+1 + x +(-2)×4 = -2
よって,x=+5
ただし,次の点に注意する必要があります。
- 例外として,過酸化水素H2O2中のOの酸化数は-1
- 例外として,金属の水素化物(水素化ナトリウムNaHなど)のHの酸化数は-1
- 「+」も省略せずに書く。
- 原子1個あたりの値を書く。CO2中のOの酸化数を(-2)×2=-4 とするのは誤り。1個あたりの値なので,酸化数は-2である。
おまけ話
上に,酸化数は原子のもつ電荷の指標だと書きました。イオンとなっている場合はわかりやすいのですが,共有結合の場合はどのような扱いになるのでしょうか。
共有結合は,2つの原子がそれぞれの不対電子を共有して生じる結合です。2つの原子の間には共有電子対が存在していますが,同等に共有しているわけではありません。
結合の極性で説明した通り,共有電子対は電気陰性度の大きい原子の方に引き寄せられています。そのため,共有結合の相手の原子がもっていた電子を自分のものにしていると考えます。
たとえば,フッ化水素HFではHとFの間に1対の共有電子対があります。電気陰性度はFの方が大きいので,Hがもっていた電子を自分のものにしていると考えます。その結果,Fは陽子よりも電子を1つ多くもっている状態なので-1,Hは陽子よりも電子が1つ少ないので+1の酸化数と考えることができるのです。
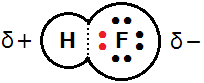
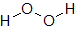 ここで,過酸化水素H2O2中のOの酸化数について考えてみます。過酸化水素は右図のような構造をしています。O-H結合では,OはHがもっていた電子を自分のものにしていると考えるので,酸化数は1だけ減ります。ただし,O-O結合では同じ原子で電子対を共有しています。電気陰性度の差がないので電子はどちらにも引き寄せられておらず,この結合による酸化数の変化はありません。
ここで,過酸化水素H2O2中のOの酸化数について考えてみます。過酸化水素は右図のような構造をしています。O-H結合では,OはHがもっていた電子を自分のものにしていると考えるので,酸化数は1だけ減ります。ただし,O-O結合では同じ原子で電子対を共有しています。電気陰性度の差がないので電子はどちらにも引き寄せられておらず,この結合による酸化数の変化はありません。
酸素原子は2番目に電気陰性度の大きい元素なので,通常は2つの電子を引き寄せます。そのため,化合物中の酸素原子の酸化数は-2となるのですが,酸素原子どうしの結合では電子を引き寄せられず酸化数が-1となるのです。
ちなみに,最も電気陰性度の大きい元素はフッ素Fです。フッ素と酸素の化合物であるフッ化酸素OF2では,フッ素原子が電子を引きつけているので酸化数-1,酸素原子は電子が2つ離れているので酸化数+2となります。
また,電気陰性度による酸化数の求め方を理解していると,同じ種類の元素なのに化合物中で異なる酸化数になる原子についても考えることができます。
たとえば,酢酸CH3COOH中のCの酸化数を求めることができるのです。
上記の酸化数の求め方に従うと,炭素原子の酸化数をxとおいて,x×2 + 1×4 + (-2)×2 = 0 より,x=0となります。
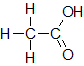 しかし,右図の構造式で考えると,左側のCは3つのH,1つのCと結合しています。Cの電気陰性度はHよりも大きいので,3つの電子を引き寄せていることになります。また,隣のCとは電子の偏りはなく酸化数は変化しません。よって,このCの酸化数は-3であることがわかります。
しかし,右図の構造式で考えると,左側のCは3つのH,1つのCと結合しています。Cの電気陰性度はHよりも大きいので,3つの電子を引き寄せていることになります。また,隣のCとは電子の偏りはなく酸化数は変化しません。よって,このCの酸化数は-3であることがわかります。
一方,右側のCはOと合計3対の電子対を共有しています。ここで3つの電子が離れている状態なので,酸化数は+3であることがわかります。
先ほどの酸化数0という計算結果は,酸化数-3のCと酸化数+3のCの平均値を求めたものなのです。
また,電子を分割することはできないので,酸化数は分数や小数にはなりません。
四酸化三鉄Fe3O4という物質がありますが,ここに含まれるFeの酸化数を求めると,+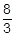 という値になります。これは,酸化数+2のFe(つまり鉄イオン(Ⅱ)Fe2+)と酸化数+3のFe(鉄イオン(Ⅲ)Fe3+)が1:2で存在しているのだと考えられます。
という値になります。これは,酸化数+2のFe(つまり鉄イオン(Ⅱ)Fe2+)と酸化数+3のFe(鉄イオン(Ⅲ)Fe3+)が1:2で存在しているのだと考えられます。
スポンサーリンク