「電池の原理」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸化還元反応 > 電池の原理
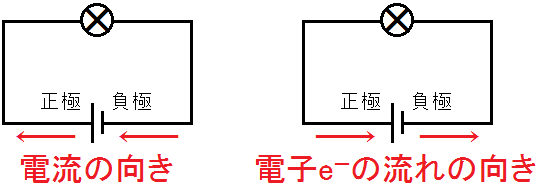
電流と電子の流れ
電池には,正極と負極があります。正極から外部を通って負極へと電流が流れています。
しかし,この定義は正電荷の流れという認識でつくられたものです。実際は,導線内を負電荷の電子e-が負極から外部を通って正極へと流れています。
酸化還元反応は,電子e-の受け渡しの反応ですので,電子の動きに注目することになります。
電池を学習するにあたって,負極から電子e-が流れ出て,正極に電子e-が戻ってくるというイメージをつくっておきましょう。
スポンサーリンク
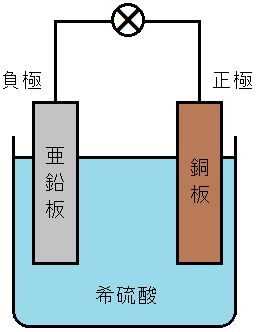
電池の原理とボルタ電池
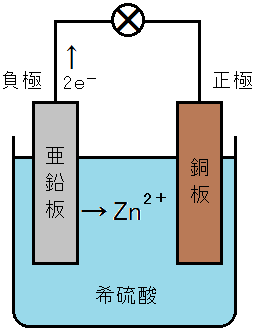
希硫酸に亜鉛板と銅板を浸したものをボルタ電池といいます。亜鉛板が負極,銅板が正極となり,1.1V程度の起電力をもっています。
このように,2種類の金属を電解質水溶液に浸すことで,電池をつくることができます。
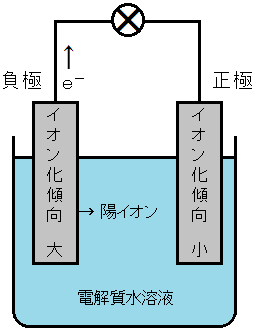
金属にはイオン化傾向があり,電子e-を放出して陽イオンになる能力があります。2種類の金属のうち,イオン化傾向の大きい金属が電子e-を放出することができるのです。
このことから,電池を構成する2種類の金属のうち,イオン化傾向の大きい方が負極になることがわかります。
一方,電子を放出することができなかった金属の方には,電子e-が流れてくることになります。金属が電子e-を受け取って陰イオンになることは通常ありませんので,水溶液中のイオンや分子のうち,電子e-を受け取りやすいものが反応することになります。ボルタ電池では,水素イオンH+が電子e-を受け取って水素H2が発生します。
電池の起電力
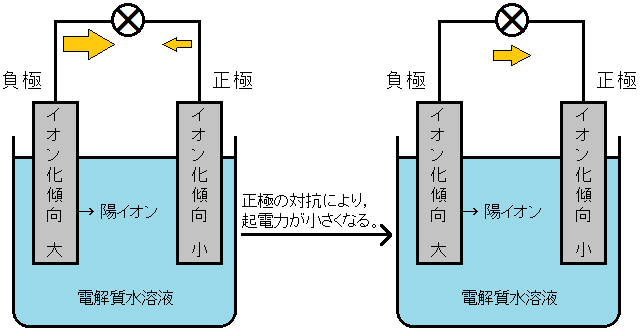
電池を構成する2種類の金属のうち,イオン化傾向の大きい金属が電子e-を放出して陽イオンになるので,負極となります。そのため,負極となる金属のイオン化傾向が大きいほど,その電池の起電力は大きくなります。
一方,正極となる金属も起電力に影響しています。
電池を構成する2種類の金属は,どちらも電子e-を放出して陽イオンになろうとしています。イオン化傾向の大きい方の金属だけが電子e-を放出することができますが,他方の正極も電子e-を放出しようとして対抗しているのです。
よって,正極となる金属のイオン化傾向が小さいほど,負極からの電子e-の放出が妨げられず,起電力が大きくなるのです。
たとえば,亜鉛が電子e-を放出する能力を2.28,銅が電子e-を放出する能力を1.18とします。すると,亜鉛が電子e-を放出する能力2.28のうち,1.18が銅によって相殺されて,残りの1.10を起電力として発揮することができたということになるのです。
スポンサーリンク