センター試験の化学の演習問題を紹介しています。このページは,電離平衡の解説です。
高校化学Net参考書 ~センター試験演習「化学」~
問題情報
| 年度 | 2016年度 |
|---|---|
| 試験 | 本試験-化学 |
| 問題 | 第2問-問4 |
| 単元 | 電離平衡 |
| 配点 | 4点 |
| 計算問題 | ○ |
| 難易度 | 難しい |
正解
② 2.0×10-5
スポンサーリンク
解説
酸の電離定数Kaを各物質(イオン)のモル濃度で表した式に,数値を代入して酢酸イオンのモル濃度を求めます。
CH3COOH 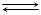 CH3COO- + H+
CH3COO- + H+
Ka= 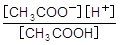
この問題で重要なのは,ルシャトリエの原理に基づいた近似です。
強酸である塩酸はすべて電離していると考えますので,[H+]が十分に大きくなります。そのため,酢酸の電離は大きく左に偏っており,ほとんど電離していないと考えられます。
よって,[CH3COOH]は加えた酢酸がすべて残っていると考えて求められます。また,酢酸の電離によって生じるH+が少ないため,[H+]は塩酸のものだけだというように考えます。
今回の問題を解く上では省略しても正解が出てくるのですが,水溶液の混合により体積が増加したので,酢酸や塩酸の濃度は小さくなっています。どちらも50mLから100mLと体積が2倍になっているので,モル濃度は半分になっています。
[CH3COOH] = 0.016mol/L × 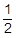 = 0.0080mol/L
= 0.0080mol/L
[H+] = 0.020mol/L × 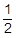 = 0.010mol/L
= 0.010mol/L
Ka= 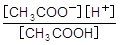 に代入して
に代入して
2.5×10-5mol/L = ![[CH3COO-]×0.010/0.0080](img/2016_honshiken_kagaku_2_4_3.png)
[CH3COO-] = 2.0×10-5mol/L
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |