センター試験の化学Ⅰの演習問題を紹介しています。このページは,炭化水素の燃焼熱の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 炭化水素の燃焼熱 |
|---|---|
| 年度 | 2008年度 |
| 問題番号 | 化学Ⅰ-第2問-問1 |
| 配点 | a‐4,b‐3 |
| 計算問題 | ○ |
| 難易度 | 難しい |
正解
a‐④ 1920
b‐① 4
スポンサーリンク
解説
分子式C3Hnの炭化水素の完全燃焼は,次の化学反応式で表されます。
C3Hn + 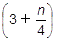 O2 → 3CO2 +
O2 → 3CO2 + 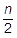 H2O
H2O
a 完全燃焼により二酸化炭素3.30gが生成しています。まずは,この二酸化炭素の物質量〔mol〕を求めます。
CO2=44
3.30g ÷ 44g/mol = 0.075mol
上記の化学反応式の係数より,炭化水素C3Hnと二酸化炭素CO2は物質量比1:3の反応なので,反応した炭化水素C3Hnの物質量〔mol〕を求めることが出来ます。
0.075mol ÷ 3 = 0.025mol
よって,0.025molの炭化水素C3Hnが完全燃焼したときに,48.0kJの熱が発生したことがわかります。燃焼熱〔kJ/mol〕は,1molあたりの値ですので,1molの炭化水素C3Hnが完全燃焼するときの熱量を求めます。
48.0kJ ÷ 0.025mol = 1920kJ/mol
(または,0.025mol : 48.0kJ = 1mol : Q〔kJ〕)
b いろんな解法が考えられますが,最もわかりやすいのは二酸化炭素CO2と水H2Oの物質量比で考えるものだと思います。
生成した水の質量が0.900gなので,その物質量〔mol〕が求められます。
H2O=18
0.900g ÷ 18g/mol = 0.050mol
aで求めた二酸化炭素との物質量比が,化学反応式の係数の比と等しくなります。
0.075mol : 0.050mol = 3 : 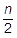
これを解いて,n=4です。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |