センター試験の化学Ⅰの演習問題を紹介しています。このページは,中和滴定と電離度の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 中和滴定と電離度 |
|---|---|
| 年度 | 2008年度 |
| 問題番号 | 化学Ⅰ-第2問-問2 |
| 配点 | a‐3,b‐4 |
| 計算問題 | ○ |
| 難易度 | 難しい |
正解
a‐② 0.020
b‐③ 2.8×10-2
スポンサーリンク
解説
a 中和反応における量的関係は,
「酸から生じるH+の物質量〔mol〕=塩基から生じるOH-の物質量〔mol〕」
で表すことが出来ます。酸から生じるH+の物質量〔mol〕は,
「酸の価数×酸の物質量〔mol〕」
で求めることが出来ます。また,水溶液の場合は,「モル濃度〔mol/L〕×水溶液の体積〔L〕=酸の物質量〔mol〕」となることから,
「酸の価数×モル濃度〔mol/L〕×水溶液の体積〔L〕」
で求めることも出来ます。塩基についても同様に考えられますので,「acv=a’c’v’」のように公式化されています。酢酸は1価の酸,水酸化ナトリウムは1価の塩基です。その他,問題文で与えられている値を代入すると,次のような式になります。
1 × 0.036mol/L × 0.0100L = 1 × c’ × 0.0180L
c’ = 0.020mol/L
b 電離度は,「溶かした電解質」に対する「電離した電解質」の割合です。物質量〔mol〕の式で定義されていますが,モル濃度〔mol/L〕で計算しても構いません(分母・分子に同じ1/vがあり,結局は約分されるため)。
「溶かした電解質」のモル濃度〔mol/L〕は,酢酸のモル濃度なので,0.036mol/Lです。一方,「電離した電解質」のモル濃度〔mol/L〕はpHから求めます。次の化学反応式より,生じた水素イオンH+の物質量と電離して減少した酢酸CH3COOHの物質量が等しいからです。
CH3COOH 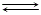 CH3COO- + H+
CH3COO- + H+
水素イオン指数pHは,次のように定義されています。
pH = -log10[H+] または,[H+]=1.0×10-a ⇔ pH=a
この問いではpHが3.0なので,[H+]=1.0×10-3です。上記のように,H+が増加した分だけCH3COOHが電離しているので,「電離した電解質」のモル濃度は1.0×10-3mol/Lです。よって,この酢酸水溶液中の酢酸の電離度は,次のように求められます。
電離度 = (1.0×10-3mol/L)÷(0.036mol/L) = 0.0277・・・ = 0.028
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |