センター試験の化学Ⅰの演習問題を紹介しています。このページは,質量パーセント濃度の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 質量パーセント濃度 |
|---|---|
| 年度 | 2009年度 |
| 問題番号 | 化学Ⅰ-第1問-問5 |
| 配点 | 4 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
③ 0.22
スポンサーリンク
解説
3段階の計算の流れをイメージできるかどうかがポイントです。
・溶液の体積〔cm3〕と密度〔g/cm3〕から,溶液の質量〔g〕を求めます。
100cm3 × 1.1g/cm3 = 110g
・溶液の質量〔g〕と質量パーセント濃度〔%〕から,溶質である水酸化ナトリウムの質量〔g〕を求めます。
110g × 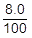 = 8.8g
= 8.8g
・水酸化ナトリウムNaOHの質量〔g〕とその式量(モル質量〔g/mol〕)から,水酸化ナトリウムの物質量〔mol〕を求めます。
NaOH = 23×1 + 16×1 + 1.0×1 = 40
8.8g ÷ 40g/mol = 0.22mol
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |