センター試験の化学Ⅰの演習問題を紹介しています。このページは,沈殿反応の量的関係の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 沈殿反応の量的関係 |
|---|---|
| 年度 | 2009年度 |
| 問題番号 | 化学Ⅰ-第3問-問5 |
| 配点 | 4 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
③ 3.0
スポンサーリンク
解説
塩化ナトリウム水溶液と硝酸銀水溶液の反応は,次のように表すことが出来ます。下向きの矢印は,沈殿することを示しています。
NaCl + AgNO3 → AgCl↓ + NaNO3
化学反応式の係数比は,物質量〔mol〕の比を表しています。塩化ナトリウムNaClと硝酸銀AgNO3は,物質量比1:1で反応しています。
反応に要した硝酸銀AgNO3の物質量〔mol〕は,モル濃度〔mol/L〕と体積〔L〕の積で求められます。
0.050mol/L × 0.0060L = 3.0×10-4mol
しょうゆ中の塩化ナトリウムNaClのモル濃度をc〔mol/L〕とおくと,100倍に希釈した試料溶液のモル濃度〔mol/L〕は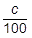 〔mol/L〕です。その10mL中に含まれている塩化ナトリウムNaClの物質量〔mol〕は,次のように表すことが出来ます。
〔mol/L〕です。その10mL中に含まれている塩化ナトリウムNaClの物質量〔mol〕は,次のように表すことが出来ます。
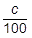 〔mol/L〕 × 0.010L = c×10-4mol
〔mol/L〕 × 0.010L = c×10-4mol
先述のように,反応する硝酸銀AgNO3と塩化ナトリウムNaClの物質量〔mol〕は等しいので,次の式が成り立ちます。
3.0×10-4mol = c×10-4mol
c = 3.0
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |