センター試験の化学Ⅰの演習問題を紹介しています。このページは,付加反応の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 付加反応 |
|---|---|
| 年度 | 2010年度 |
| 問題番号 | 化学Ⅰ-第4問-問6 |
| 配点 | 4 |
| 計算問題 | ○ |
| 難易度 | 難しい |
正解
⑤
スポンサーリンク
解説
元素分析により有機化合物の組成式を求める問題は頻出です。
まず先に燃焼ガスを塩化カルシウム管に通じて水H2Oを吸収し,次にソーダ石灰管に通じて二酸化炭素CO2を吸収します。それぞれの吸収管の質量増加から,発生した水や二酸化炭素の質量を求めることが出来ます。これらの値から,そこに含まれる水素原子Hと炭素原子Cの物質量〔mol〕を求めることが出来ます。この問題では「炭化水素」を用いていますので,CとHだけでできています。C,Hの物質量の比がわかるので,組成式を示すことが出来ます。
・308mgの二酸化炭素(CO2=44)に含まれる炭素原子(C=12)の物質量〔mmol(ミリモル)〕
308mg ÷ 44mg/mmol × 1 = 7mmol
*1mol=1000mmol(1mmol=10-3mol)
*二酸化炭素分子1個に炭素原子1個なので,1をかけています。
・108mgの水(H2O=18)に含まれる水素原子(H=1.0)の物質量〔mmol〕
108mg ÷ 18mg/mmol × 2 = 12mmol
*水分子1個に水素原子2個なので,2をかけています。
この結果から,CとHの物質量の比は,7:12ということがわかります。
炭素数7の炭化水素なので,水素原子数は12です。よって,実験に用いた鎖式不飽和炭化水素の分子式はC7H12だとわかります。
ここで,選択肢は①と⑤に絞られます。
次に,生成物に含まれるBrの質量の割合から,付加反応の量的関係を求めます。臭素Br2は,二重結合1か所に対して1分子が付加します(選択肢にはありませんが,三重結合なら,1か所に対して2分子の臭素Br2が付加します)。
この不飽和炭化水素1分子に二重結合がnか所あるとおくと,その付加反応は次のように表すことが出来ます。
C7H12 + nBr2 → C7H12Br2n
生成物の分子量は,12×7 + 1.0×12 + 80×2n です。このうち,臭素原子だけの値は,80×2n です。その割合が77%なので,次の方程式が成り立ちます。
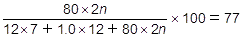
これを解いて,n=2 です。
センター試験のように選択肢がある場合は,方程式を解くよりも,候補となる値を代入して確認する方が,計算が楽です。上記のように,選択肢①と⑤に絞られており,それぞれ二重結合の数は1か所と2か所です。n=1を代入すると臭素の質量の割合は62.5%,n=2を代入すると76.9%です。よって,二重結合は2か所だと判断することが出来ます。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |