センター試験の化学Ⅰの演習問題を紹介しています。このページは,中和滴定の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 中和滴定 |
|---|---|
| 年度 | 2011年度 |
| 問題番号 | 化学Ⅰ-第2問-問5 |
| 配点 | a‐3,b‐4 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
a ③ 操作2において,コニカルビーカーの内部に水滴が残っていたので,内部をBで洗ってから用いた。
b ④ 0.825
スポンサーリンク
解説
a ① ホールピペットの内部に水滴が残っていると,その分だけ水溶液が少なくなってしまいます。
② メスフラスコの内部に水滴が残っていても問題はありません。あとから水を入れて体積を合わせる操作をするので,先に水が入っていても結局は同じことになるからです。
③ コニカルビーカーの内部に水滴が残っていても問題はありません。重要なのは溶質の物質量〔mol〕だからです。極端な話,水が入っていて体積が2倍になっても,濃度が半分になっているので,溶質の物質量は同じです。
逆に,次に用いる水溶液で洗ってしまうと,溶質が入り込んでしまうので,その物質量が変わってしまいます。
④ ビュレットの内部に水滴が残っていると,濃度のわかっている水溶液の濃度が変化してしまいます。
⑤ ビュレットの先端まで水溶液が入っていないと,コックを開いたときに,まずはその部分に水溶液が入ります。ビュレットの液面は下がっていくのにコニカルビーカーには水溶液が入っていかないので,実際に反応した体積よりも大きな値になってしまいます。そのため,滴定を始める前に,ビュレットの先端まで水溶液を満たす必要があります。
b 中和反応における量的関係は,
「酸から生じるH+の物質量〔mol〕=塩基から生じるOH-の物質量〔mol〕」
で表すことが出来ます。酸から生じるH+の物質量〔mol〕は,
「酸の価数×酸の物質量〔mol〕」
で求めることが出来ます。また,水溶液の場合は,「モル濃度〔mol/L〕×水溶液の体積〔L〕=酸の物質量〔mol〕」となることから,
「酸の価数×モル濃度〔mol/L〕×水溶液の体積〔L〕」
で求めることもできます。塩基から生じるOH-の物質量〔mol〕も同様です。ここで,酢酸水溶液Aのモル濃度をc〔mol/L〕とおくと,操作1で10倍希釈しているので,中和滴定に用いた水溶液Cのモル濃度は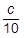 〔mol/L〕になっています。よって,次の式が成り立ちます。
〔mol/L〕になっています。よって,次の式が成り立ちます。
1 × 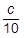 × 0.010L = 1 × 0.110mol/L × 0.00750L
× 0.010L = 1 × 0.110mol/L × 0.00750L
これを解いて,c=0.825mol/Lです。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |