センター試験の化学Ⅰの演習問題を紹介しています。このページは,ヘスの法則の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | ヘスの法則 |
|---|---|
| 年度 | 2013年度 |
| 問題番号 | 化学Ⅰ-第2問-問1 |
| 配点 | 4 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
③ -131
スポンサーリンク
解説
反応熱を求めるときは,問題で与えられた反応をすべて熱化学方程式で表して,連立方程式を解く要領で求めます。多くの場合,「化合物=単体と熱」に変形したものを,「化合物が2種類以上ある式」に代入して求めることができます。
C(黒鉛) + H2O(気) = CO(気) + H2(気) + Q ・・・ (1)
H2(気) + 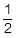 O2(気) = H2O(気) + 242kJ ・・・ (2)
O2(気) = H2O(気) + 242kJ ・・・ (2)
C(黒鉛) + 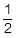 O2(気) = CO(気) + 111kJ ・・・ (3)
O2(気) = CO(気) + 111kJ ・・・ (3)
(2)より,H2O(気) = H2(気) + 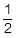 O(気) - 242kJ ・・・ (2)’
O(気) - 242kJ ・・・ (2)’
(3)より,CO(気) = C(黒鉛) + 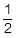 O2(気) - 111kJ ・・・ (3)’
O2(気) - 111kJ ・・・ (3)’
(2)’と(3)’を(1)に代入してQについて解くと,Q = -131kJ
ちなみに,加減法では (1)+(2)-(3) で求めることができます。
また,(1)について,(生成物の生成熱の総和)-(反応物の生成熱の総和)で求めることもできます。このとき,単体の生成熱は0kJ/molです。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |