センター試験の化学Ⅰの演習問題を紹介しています。このページは,銅の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 銅 |
|---|---|
| 年度 | 2013年度 |
| 問題番号 | 化学Ⅰ-第3問-問5 |
| 配点 | 4 |
| 計算問題 | × |
| 難易度 | 易しい |
正解
① 硫酸銅(Ⅱ)水溶液に,希塩酸を加えて硫化水を通じても,沈殿は生じない。
スポンサーリンク
解説
① 硫化水素を通じたときに沈殿を生じるかどうかは,イオン化列で考えます。
K Ca Na Mg Al | Zn Fe Ni | Sn Pb (H) Cu Hg Ag Pt Au
~Alのグループは,沈殿を生じません。例えば,カリウムイオンK+を含む水溶液に硫化水素を通じても,沈殿を生じないということです。
Sn~のグループは,条件に関わらず沈殿を生じます。
Zn,Fe,Niのグループは,水溶液が塩基性なら硫化水素を通じたときに沈殿を生じますが,酸性なら沈殿を生じません。
沈殿の色も確認しておいてください。イオン化列に載っている金属の硫化物のうちZnSは白色で,それ以外の硫化物は黒色です。また,それ以外の金属として,カドミウムCdは「Sn~のグループ」でCdSは黄色,マンガンMnは「Zn,Fe,Niのグループ」でMnSは淡赤色です。
② アンモニア水中には,アンモニアNH3と水H2Oの反応により水酸化物イオンOH-が生じています。
NH3 + H2O 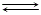 NH4+ + OH-
NH4+ + OH-
銅(Ⅱ)イオンCu2+を含む硫酸銅(Ⅱ)水溶液にアンモニア水を加えると,まずは水酸化銅(Ⅱ)Cu(OH)2の青白色沈殿を生じます。
Cu2+ + 2OH- → Cu(OH)2
また,銅(Ⅱ)イオンを含む化合物は,多量のアンモニア分子があると錯イオンを形成して溶解します。
Cu(OH)2 + 4NH3 → [Cu(NH3)4]2+ + 2OH-
よって,記述のように硫酸銅(Ⅱ)水溶液に,アンモニア水を少量加えると青白色沈殿を生じますが,さらに加えると生じた沈殿が錯イオンとなって溶けます。銅(Ⅱ)イオンの他,亜鉛イオンZn2+,銀イオンAg+も同様にふるまいます。
③ イオン化傾向を比較すると銅よりも亜鉛の方が大きく,亜鉛の方が陽イオンになりやすいことが分かります。しかし反応前は,イオンになりやすい亜鉛が単体で,イオンになりにくい銅がイオンになっています。そこで,電子の受け渡しを行って,イオン化傾向の順と合致する状態になります。
Zn → Zn2+ + 2e-
Cu2+ + 2e- → Cu
⇒ Zn + Cu2+ → Zn2+ + Cu
このようにして,硫酸銅(Ⅱ)水溶液に亜鉛の粒を加えると,単体の銅が析出します。
④,⑤ 銅の電解精錬は,硫酸銅(Ⅱ)水溶液を用いた電気分解です。陰極では外部電源から流れてきた電子e-を受け取る反応,陽極では外部電源に電子e-を送る反応がそれぞれ起こります。
陰極 : Cu2+ + 2e- → Cu
陽極 : Cu → Cu2+ + 2e-
陽極(粗銅)では銅が溶出しますが,銅よりもイオン化傾向の小さい金属は陽イオンになれずに沈殿します。このようにして,不純物としてのイオン化傾向の小さい金属が取り除かれます。
陰極では銅が析出しますが,銅よりもイオン化傾向の大きい金属は陽イオンのまま電解液中に残ります。このようにして,不純物としてのイオン化傾向の大きい金属が取り除かれます。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |