センター試験の化学Ⅰの演習問題を紹介しています。このページは,量的関係の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 量的関係 |
|---|---|
| 年度 | 2013年度 |
| 問題番号 | 化学Ⅰ-第3問-問6 |
| 配点 | 4 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
② 0.64
スポンサーリンク
解説
この操作では,次の反応が起こっています。
FeCl3 + 3OH- → Fe(OH)3 + 3Cl-
2Fe(OH)3 → Fe2O3 + 3H2O
ちなみに,最初の式の水酸化物イオンOH-は,アンモニアNH3と水H2Oの反応により生じたものです。
NH3 + H2O 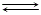 NH4+ + OH-
NH4+ + OH-
この問題を解くときには,上の2つの式を1つにまとめて量的関係を考えます。しかし,量的関係を考えるときには「注目する元素」だけを考えれば十分です。つまり,塩化鉄(Ⅲ)から酸化鉄(Ⅲ)が生じることを鉄原子の数を合わせて反応式で表し,それ以外の物質は省略してしまうのです。
2FeCl3 → Fe2O3
この反応式から,2molの塩化鉄(Ⅲ)から1molの酸化鉄(Ⅲ)が生じることが分かります。そこで,まずは塩化鉄(Ⅲ)の物質量を求めます。
0.40mol/L × 0.020L = 0.0080mol
0.0080molの塩化鉄(Ⅲ)から生じる酸化鉄(Ⅲ)は,0.0080mol÷2=0.0040molです。酸化鉄(Ⅲ)の式量は,Fe2O3 = 56×2 + 16×3 = 160 なので,酸化鉄(Ⅲ)の質量を求めることができます。
160g/mol × 0.0040mol = 0.64g
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |