センター試験の化学Ⅰの演習問題を紹介しています。このページは,質量パーセント濃度とモル濃度の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 質量パーセント濃度とモル濃度 |
|---|---|
| 年度 | 2014年度 |
| 問題番号 | 化学Ⅰ-第1問-問4 |
| 配点 | 4 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
④ 1.0
スポンサーリンク
解説
モル濃度を求めるためには,溶液の体積〔L〕と溶質の物質量〔mol〕が必要です。このうち,希硫酸の体積は500mL,つまり0.50Lと与えられています。
溶質としてのHClの物質量〔mol〕を求めるために,その質量〔g〕と分子量36.5から計算します。
希釈前の塩酸の質量は50gで,そのうちの36.5%がHClです。よって,次式でHClの質量〔g〕を表すことができます。ちなみに,次の計算を見越して,掛け算をせずに残しています。
50g×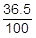 =0.50×36.5〔g〕
=0.50×36.5〔g〕
物質量〔mol〕は,質量をw〔g〕,分子量をMとおくと,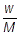 で求めることができます。よって,HClの物質量〔mol〕を次のように求めることができます。
で求めることができます。よって,HClの物質量〔mol〕を次のように求めることができます。
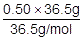 =0.50〔mol〕
=0.50〔mol〕
この希塩酸は,0.50L中に0.50molの溶質を含んでいますので,モル濃度〔mol/L〕は,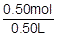 =1.0mol/L です。
=1.0mol/L です。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |