センター試験の化学Ⅰの演習問題を紹介しています。このページは,酸化還元反応の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 酸化還元反応 |
|---|---|
| 年度 | 2014年度 |
| 問題番号 | 化学Ⅰ-第3問-問2 |
| 配点 | 3 |
| 計算問題 | × |
| 難易度 | 易しい |
正解
④ 過酸化水素の酸素の酸化数は-1である。
スポンサーリンク
解説
① この化学反応では,過酸化水素H2O2が過マンガン酸イオンによって酸化され,酸素が発生します。
H2O2 → O2 + 2H+ + 2e-
② MnO4-中のMn原子の酸化数は,次のように求めることができます。
x×1 + (-2)×4 = -1 ⇒ x = +7
③ 過マンガン酸イオンは酸化剤として働くので,自身は還元されます。このとき,水溶液の液性によってどこまで還元されるのかが異なります。
この問題では,硫酸を加えて酸性にしています。酸性の場合,過マンガン酸イオンMnO4-は酸化剤として働いてマンガンイオンMn2+を生じます。マンガンイオンのMn原子の酸化数は,+2です。
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
ちなみに,中性や塩基性の水溶液の場合は,酸化マンガン(Ⅳ)MnO2を生じます。MnO2中のMn原子の酸化数は,+4です。
MnO4- + 2H2O + 3e- → MnO2 + 4OH-
④ 通常,化合物中の酸素原子の酸化数は-2ですが,過酸化水素中の酸素原子の酸化数は例外的に-1です。
酸素原子は電気陰性度が大きいため,共有結合している相手の原子から共有している電子を強く引きつけています。原子価が2なので,2本の共有結合で電子を2つ引きつけていることになります。そのため,化合物中では酸化数が-2になりやすいのです。
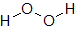
ただし,過酸化水素では酸素原子どうしで共有結合している部分があり,ここでは一方が強く引きつけているということがおこりません。水素原子と結合している分でしか電子を引きつけていませんので,酸化数が-1となるのです。
⑤ 硫黄原子は,水溶液中では硫酸イオンSO42-として存在しています。反応前後で変化していませんので,もちろん酸化数も変化していません。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |