センター試験の化学の演習問題を紹介しています。このページは,溶解度積の解説です。
高校化学Net参考書 ~センター試験演習「化学」~
問題情報
| 年度 | 2015年度 |
|---|---|
| 試験 | 本試験-化学 |
| 問題 | 第2問-問3 |
| 単元 | 溶解度積 |
| 配点 | 4点 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
④ 実験Ⅰ‐有 実験Ⅱ‐無 実験Ⅲ‐無
スポンサーリンク
解説
塩化銀の溶解度積は,Ksp=[Ag+][Cl-]=1.8×10-10(mol/L)2で表されます。
「沈殿を生じていない場合のモル濃度」をKspの式に代入し,その値がKspを超えていれば沈殿を生じます。沈殿した分だけイオンのモル濃度は減少し,Kspの値に落ち着きます。Kspの値を超えなければ沈殿は生じておらず,溶解平衡の状態になっていません。
ただし,溶液を混合する場合には,混合によって濃度が変わる(うすくなる)ことに注意が必要です。この問題では100mLずつを混合していますので,体積は2倍,つまり各イオンのモル濃度は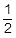 倍になっています。
倍になっています。
実験Ⅰ 混合によって,沈殿を生じていない場合のモル濃度は,
[Ag+]=1.0×10-3mol/L,[Cl-]=1.0×10-3mol/L になります。
[Ag+][Cl-]=1.0×10-6(mol/L)2 > Ksp より,沈殿を生じます。
実験Ⅱ 混合によって,沈殿を生じていない場合のモル濃度は,
[Ag+]=1.0×10-5mol/L,[Cl-]=1.0×10-5mol/L になります。
[Ag+][Cl-]=1.0×10-10(mol/L)2 < Ksp より,沈殿を生じません。
実験Ⅲ 混合によって,沈殿を生じていない場合のモル濃度は,
[Ag+]=1.0×10-5mol/L,[Cl-]=5.0×10-6mol/L になります。
[Ag+][Cl-]=5.0×10-11(mol/L)2 < Ksp より,沈殿を生じません。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |