センター試験の化学の演習問題を紹介しています。このページは,電気分解の解説です。
高校化学Net参考書 ~センター試験演習「化学」~
問題情報
| 年度 | 2015年度 |
|---|---|
| 試験 | 本試験-化学 |
| 問題 | 第2問-問4 |
| 単元 | 電気分解 |
| 配点 | a‐3点 b‐4点 |
| 計算問題 | ○ |
| 難易度 | 普通 |
正解
a ② 0.50
b ⑥ 電解槽Ⅰの陽極‐銅が溶解した 電解槽Ⅱの陽極‐酸素が発生した
スポンサーリンク
解説
a 「電気量〔C〕」または「流した電子の物質量〔mol〕」で方程式を立てましょう。化学計算の基本は物質量なので,ここでは「流した電子の物質量〔mol〕」で方程式を立てます。
まずは,電流〔A〕と通電時間〔秒〕から電気量〔C〕を求め,これをファラデー定数〔C/mol〕で割ることで,流した電子の物質量〔mol〕を表します。電流をI〔A〕とおくと,流した電子の物質量は次のように表すことができます。
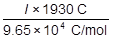
次に,析出した銅の質量〔g〕から電子の物質量を求めます。0.32gの銅(原子量64)は,0.0050molです。また,次の反応式から,流した電子の物質量〔mol〕は銅の物質量〔mol〕の2倍の0.010molです。
Cu2+ + 2e- → Cu
2つの方法で求めた電子の物質量〔mol〕は,同じ現象についての値なので,等しくなります。よって,次の方程式が成り立ち,I=0.50となります。
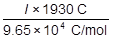 =0.010mol
=0.010mol
b 電気分解の問題では,電極でおこる反応を判断することが重要です。電解液や電極として存在する物質やイオンのうち,陰極では電子を受け取りやすいものが,陽極では電子を放出しやすいものが反応します。
電解槽Ⅰの陽極では,次のように反応して銅が溶解します。
Cu → Cu2+ + 2e-
電解槽Ⅱの陽極では,次のように反応して酸素が発生します。
2H2O → O2 + 4H+ + 4e-
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |