センター試験の化学Ⅰの演習問題を紹介しています。このページは,アンモニアの発生の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | アンモニアの発生 |
|---|---|
| 年度 | 2008年度 |
| 問題番号 | 化学Ⅰ-第3問-問4 |
| 配点 | a‐3,b‐4 |
| 計算問題 | ○ |
| 難易度 | 難しい |
正解
a‐③ 水酸化カルシウムの代わりに硫酸カルシウムを用いると,アンモニアがより激しく発生した。
b‐④
スポンサーリンク
解説
① アンモニアNH3が水H2Oに溶けると,水酸化物イオンOH-を生じて塩基性になります。そのため,赤色リトマス紙は青色になります。
NH3 + H2O 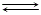 NH4+ + OH-
NH4+ + OH-
② アンモニアNH3と塩化水素HClが空気中で混ざると,塩化アンモニウムNH4Clの細かい粒が生じて白煙になります。この変化は,アンモニアと塩化水素双方の検出に用いられます。
NH3 + HCl → NH4Cl
③ 塩化アンモニウムNH4Clに水酸化カルシウムCa(OH)2を加えると,弱塩基の遊離によってアンモニアが発生します。水酸化カルシウムの代わりになるのは水酸化ナトリウムNaOHなどの強塩基ですが,硫酸カルシウムは強酸と強塩基の正塩なので中性です。塩基性ではないので水酸化カルシウムの代わりに用いることが出来ません。
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
④ ソーダ石灰は,水酸化ナトリウムNaOHと酸化カルシウムCaOの混合物であり,代表的な乾燥剤です。塩基性の乾燥剤なので,塩基性のアンモニアを吸収してしまうことはありません。
⑤ 反応後には,生成物として塩化カルシウムCaCl2の固体が試験管内に残ります。
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
b アンモニア発生の変化は,次の化学反応式で表されます。
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
量的関係では,化学反応式の係数の比が物質量〔mol〕の比となります。係数が同じなので,反応した塩化アンモニウムNH4Clの物質量〔mol〕と発生したアンモニアNH3の物質量〔mol〕は等しくなります。ここで,選択肢のうち③と④に絞ることが出来ます。
次に,水酸化カルシウムCa(OH)2と塩化アンモニウムNH4Clの物質量〔mol〕の関係を確認します。水酸化カルシウム1molがあれば,塩化アンモニウムは2molまで反応することが出来ます。この問いでは0.010molの水酸化カルシウムを用いていますので,塩化アンモニウムは0.020molまで反応することが出来ます。③のグラフでは塩化アンモニウムは0.010molまでしか反応しないということになってしまいますので,これは誤りです。よって,④のグラフが正しいことになります。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |