センター試験の化学Ⅰの演習問題を紹介しています。このページは,サリチル酸の誘導体の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | サリチル酸の誘導体 |
|---|---|
| 年度 | 2008年度 |
| 問題番号 | 化学Ⅰ-第4問-問5 |
| 配点 | a‐4,b‐3 |
| 計算問題 | × |
| 難易度 | 普通 |
正解
a‐⑥
b‐④ ビーカーの内容物を分液漏斗に移し,エーテルを加えて振り混ぜた後,静置して上層を取り出す。これを蒸発皿に入れて溶媒を蒸発させる。
スポンサーリンク
解説
サリチル酸は,フェノール性ヒドロキシ基-OHとカルボキシル基-COOHの両方をもつ分子です。そのため,それぞれの官能基の反応や性質を考えさせる問題としてよく出題されます。
a 濃硫酸を触媒としてサリチル酸とメタノールを反応させると,サリチル酸のカルボキシル基とメタノールのヒドロキシ基でエステル化が起こります。サリチル酸のフェノール性ヒドロキシ基は反応せずに残ります。
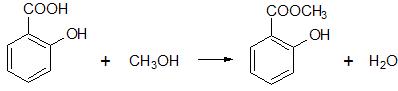
[ ウ ]の操作は,生成したサリチル酸メチルだけを分離するために行われています。濃硫酸や未反応のメタノールは水に溶けやすい物質です。未反応のサリチル酸と生成物であるサリチル酸メチルは,分子の状態では水に溶けにくく,中和された塩の状態では水にとけるようになります。よって,サリチル酸メチル以外の物質は水に溶かし,サリチル酸メチルだけを水に溶けない状態にすることで分離します。
ここで注目するのは,官能基です。サリチル酸にはフェノール性ヒドロキシ基-OHとカルボキシル基-COOHの両方がありますが,サリチル酸メチルにはカルボキシル基がありません(エステル結合は中性なので考えなくてもいい)。この場合,カルボン酸,炭酸,フェノール類の酸の強さ(電離のしやすさ,塩のつくりやすさ)の違いを利用することで分離することが出来ます。
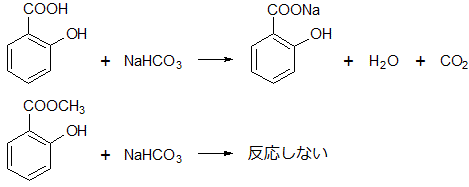
カルボキシル基は炭酸より強い酸なので,炭酸塩から炭酸(分解して水H2Oと二酸化炭素CO2になる)を遊離することが出来ます。フェノール性ヒドロキシ基は炭酸より弱い酸なので,炭酸塩から炭酸を遊離することが出来ません。6mol/L水酸化ナトリウム水溶液を用いると,カルボキシル基だけでなくフェノール性ヒドロキシ基も塩になってしまい,両方水に溶けるので分離することが出来ません。
b ①,② 得られたAは油滴なので,不純物の水溶液と一緒にろ紙を通過してしまいます。
③ 結局は不純物を含む溶液を蒸発皿に入れて,溶媒を蒸発させているので,サリチル酸などの不揮発性の物質が残ってしまいます。
④,⑤ 分液漏斗に水溶液とエーテルを入れると,2層に分離します。溶質のうち,水に溶けやすいもの(塩など)は水層に,水に溶けにくいもの(有機物の分子など)はエーテル層に抽出されます。先述のように,水に溶けにくいものはサリチル酸メチルだけになっていますので,エーテル層には不純物が含まれていません。エーテル層を取り出し,揮発性であるエーテルを蒸発させることで,サリチル酸メチルをだけ取り出すことが出来ます。
ちなみに,エーテルなどのほとんどの有機物は水よりも密度が小さいので,サリチル酸メチルを含むエーテル層が上層になります。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |