センター試験の化学Ⅰの演習問題を紹介しています。このページは,電気分解の問題です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 電気分解 |
|---|---|
| 年度 | 2009年度 |
| 問題番号 | 化学Ⅰ-第2問-問4 |
| 配点 | a‐3,b‐4 |
| 計算問題 | ○ |
| 難易度 | 難しい |
問題
| 必要があれば,原子量は次の値を使うこと。 Cu 64 |
図2の装置を用いて行った次の実験Aについて,下の問い(a・b)に答えよ。
A 0.3mol/Lの硫酸銅(Ⅱ)CuSO4水溶液を入れた容器の中で,2枚の銅板を電極とし,起電力1.5Vの乾電池を用いて一定の電流I〔A〕を時間t〔秒〕流したところ,一方の電極上に銅がm〔g〕析出した。
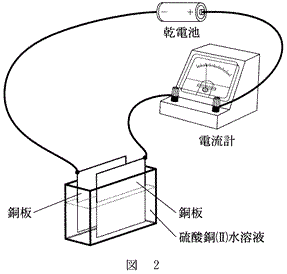
a 実験Aに関する記述として誤りを含むものを,次の①~⑤のうちから一つ選べ。
① 電流を流す時間を2t〔秒〕にすると,析出する銅の質量は2m〔g〕になる。
② 電流を2I〔A〕にすると,時間t〔秒〕の間に析出する銅の質量は2m〔g〕になる。
③ 陰極では Cu2+ + 2e- → Cu の反応によって銅が析出する。
④ 陽極ではH2Oが還元されてH2が発生する。
⑤ 実験の前後で溶液中のSO42-の物質量は変化しない。
b 実験Aから,電子1個がもつ電気量〔C〕を求める式として正しいものを,次の①~⑥のうちから一つ選べ。ただし,アボガドロ数をNとする。
① 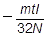
② 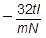
③ 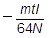
④ 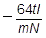
⑤ 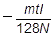
⑥ 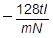
スポンサーリンク
| 正解・解説 | |
|---|---|
| ワードファイル |  |