センター試験の化学Ⅰの演習問題を紹介しています。このページは,電気分解の解説です。
高校化学Net参考書 ~センター試験演習「化学Ⅰ」~
問題情報
| 単元 | 電気分解 |
|---|---|
| 年度 | 2009年度 |
| 問題番号 | 化学Ⅰ-第2問-問4 |
| 配点 | a‐3,b‐4 |
| 計算問題 | ○ |
| 難易度 | 難しい |
正解
a‐④ 陽極ではH2Oが還元されてH2が発生する。
b‐② 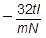
スポンサーリンク
解説
① 銅の析出は,次のように表されます。
Cu2+ + 2e- → Cu
これより,流れる電子e-の物質量〔mol〕と析出する銅Cuの物質量〔mol〕が比例することがわかります(2:1)。また,電流を流す時間を2倍にすると,流れる電気量〔C〕も2倍になり,流れる電子e-の物質量〔mol〕も2倍になります。流れる電子e-の物質量〔mol〕が2倍になれば,析出する銅Cuの物質量〔mol〕も2倍になり,その質量〔g〕も2倍になります。
② 電流を2倍にすると,流れる電気量〔C〕も2倍になります。以下,①と同様に,析出する銅の質量〔g〕も2倍になります。
③ 電気分解における「陰極」は,外部電源の負極とつながっている電極です。電池の負極からは電子e-が流れ出していますので,その電子が陰極に流れ込み,反応物(左辺の物質)となります。電解槽中に存在するCu2+,SO42-,H2O(溶媒),H+(塩の加水分解により酸性になっている)のうち,最も電子e-を受け取りやすいCu2+が反応して銅Cuを生じます。
④ 陽極では,陰極とは逆に電子e-を外部電源に送る反応が起こります。このとき,マイナスの電気をもつ電子e-が離れていくので,反応した物質にはプラスの電気が多く残ります。つまり,酸化数が増加するはずです。H2OからH2が生じるときのHの酸化数の変化は,+1→0と減少しているので,誤りだとわかります。
ちなみに,陽極ではH2Oが酸化されてO2が発生します。このときのOの酸化数の変化は,-2→0と増加しています。
⑤ 陰極での変化は, Cu2+ + 2e- → Cu です。
また,陽極での変化は, 2H2O → O2 + 4H+ + 4e- です。
SO42-は反応物にも生成物にも入っていませんので,物質量は変化しません。
b まず,流れた電気量を求めます。電流〔A〕と時間〔秒〕の積が電気量〔C〕になります。よって,流れた電気量はtI〔C〕です。ただし,電子は負の電荷をもっていますので,-tI〔C〕と表します。
次に,流れた電子e-の個数を求めます。1molの個数がアボガドロ数ですので,物質量〔mol〕とアボガドロ数Nの積が個数になります。陰極の反応式の係数比より,電子e-の物質量〔mol〕は析出した銅Cuの物質量〔mol〕の2倍です。
析出したCuの質量がm〔g〕,原子量がCu=64なので,その物質量は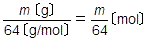 です。電子の物質量はその2倍なので,
です。電子の物質量はその2倍なので,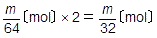 です。個数はそのN倍なので,
です。個数はそのN倍なので,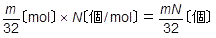 です。
です。
最後に,電子の個数と電気量〔C〕で比の式を立てて,電子1個当たりの電気量〔C〕を求めます。電子1個当たりの電気量をx〔C〕とおくと,次の式が成り立ちます。
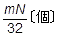 : -tI〔C〕 = 1個 : x〔C〕
: -tI〔C〕 = 1個 : x〔C〕
これを解いて, x=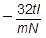 となります。
となります。
スポンサーリンク
| 問題 | |
|---|---|
| ワードファイル |  |