「第1イオン化エネルギー」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 化学結合と結晶 > 第1イオン化エネルギー
第1イオン化エネルギー
原子から電子1個を取り去って,1価の陽イオンにするために必要な最小のエネルギーを第1イオン化エネルギーといいます。
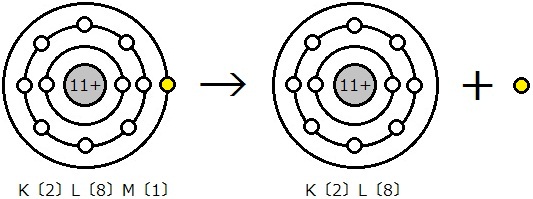
電子が1価の陽イオンになるとき,中心の原子核(プラス)から電子(マイナス)を引き離します。互いに引き合っているもの引き離すので,エネルギーを消費することになります。1価の陽イオンになりやすい原子は,このエネルギーが少なくて済みます。言い換えれば,第1イオン化エネルギーの小さい原子は,1価の陽イオンになりやすいのです。
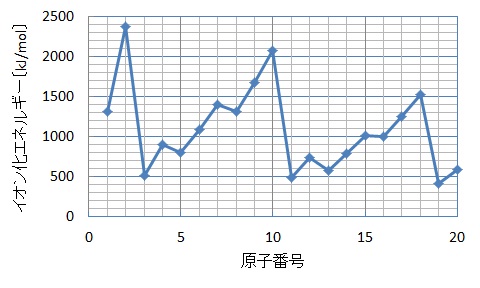
第1イオン化エネルギーは,周期律の代表例です。グラフをイメージできるようにしておきましょう。
周期表における同じ周期(横の並び)の元素では,第1族元素(H,Li,Na,K,Rb,Cs,Fr)が最も1価の陽イオンになりやすく,第1イオン化エネルギーが最小です。
また,第18族元素(He,Ne,Ar,Kr,Xe,Rn)が最も1価の陽イオンになりにくく,第1イオン化エネルギーが最大です。
ちなみに,同一周期で比較したとき,原子番号が大きくなった(右側に移動)ときに,必ずしも第1イオン化エネルギーが大きくなるとは限りません。例えば,第2周期のベリリウム4Beとホウ素5Bでは,原子番号の大きいホウ素Bの方が第1イオン化エネルギーは小さくなっています。ひっかけ問題として出題される場合がありますので,注意が必要です。
同じ族(縦の並び)では,原子番号の大きい(下の方)元素の第1イオン化エネルギーが小さくなります。これは,価電子が外側の電子殻に配置されているためです。原子核(プラス)からの距離が離れているために引き合う力が弱く,小さなエネルギーで電子を引き離すことができるのです。
おまけ話
第1イオン化エネルギーがあれば,第2イオン化エネルギーもあります。第2イオン化エネルギーは,2個目の電子を取り去るときに必要な最小のエネルギーです。第3,第4と続いています。
1価の陽イオンになりやすいナトリウムNaなどは,第1イオン化エネルギーが非常に小さいのですが,第2イオン化エネルギーは大きくなります。そのため,1個の電子だけが取り去られるのです。
一方,2価の陽イオンになりやすいマグネシウムMgなどは,第1イオン化エネルギーと第2イオン化エネルギーが両方とも小さく,第3イオン化エネルギーが大きくなります。そのため,2個の電子が取り去られるのです。
スポンサーリンク
電子親和力
原子が電子1個を受け取って,1価の陰イオンにするときに放出されるエネルギーを電子親和力といいます。
イメージしづらい内容ですが,水力発電を思い浮かべてみてください。水が低いところへと移動することで,電気エネルギーを取り出しています。高いところにある水は,地球に引きつけられています。引きつけられているものが近付くと,エネルギーが外部へと放出されるのです。
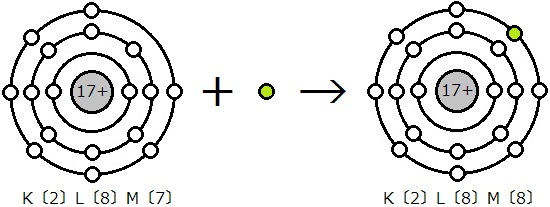
原子核と電子でも同じことが言えます。原子核(プラス)と電子(マイナス)は引き合っており,電子が近付くことで陰イオンになります。このときにエネルギーが放出されるのです。
得られる電気エネルギーが小さいときには,水力発電しようとは思われません。同じように,放出されるエネルギー(電子親和力)が小さいと,陰イオンになりづらいのです。逆に,電子親和力が大きい元素は,陰イオンになりやすいということがイメージできます。
周期表における同じ周期(横の並び)の元素では,第17族元素(F,Cl,Br,I,At)が最も1価の陰イオンになりやすく,電子親和力が最大です。
また,金属元素や安定な電子配置をもつ第18族元素(He,Ne,Ar,Kr,Xe,Rn)は陰イオンになりにくく,電子親和力は小さいです。
同じ族(縦の並び)では,原子番号の大きい(下の方)元素の電子親和力が小さくなります。最外殻が原子核から遠いため電子が近付く距離が短く,また,原子核との距離があって引きつけられる力が弱いために,放出されるエネルギーが小さいからです。
イオンの大きさ
原子やイオンの大きさは,一番外側の電子の位置で決まります。原子からイオンになるときには電子の出入りを伴いますので,その大きさが変化します。
一般に,原子が陽イオンになるときには小さくなります。これは,最外殻電子をすべて放出して,1つ内側の電子殻が最外殻となるためです。
Mg : K〔2〕L〔8〕M〔2〕 → Mg2+ : K〔2〕L〔8〕
一方,原子が陰イオンになるときには,大きくなります。最外殻電子は同じなのですが,電子が増えたことによって電子同士の反発が大きくなるからだと考えられています。
次に,異なるイオンの大きさを比較します。同族元素のイオン半径の比較は簡単です。原子番号が大きくなるほど外側の電子殻が最外殻になるので,イオン半径も大きくなります。
H+ < Li+ < Na+ < K+ < Rb+ < Cs+ < Fr+
また,同じ電子配置をもつイオンの大きさを比較する問題がよくあります。例えば,O2-,F-,Na+,Mg2+,Al3+はどれも同じ電子配置(K〔2〕L〔8〕)です。電子の数が同じなので,同じ大きさと考えるかもしれませんが,それは間違いです。ポイントは,陽子の数です。
陽子の数が多いと,原子核の正電荷が大きくなります。その結果,外側を回っている電子は中心に強く引きつけられることになります。よって,同じ電子配置なら,原子番号が大きい元素のイオンほど縮んで小さくなるのです。
O2- > F- > Na+ > Mg2+ > Al3+
スポンサーリンク