「イオン結晶」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 化学結合と結晶 > イオン結晶
イオン結晶
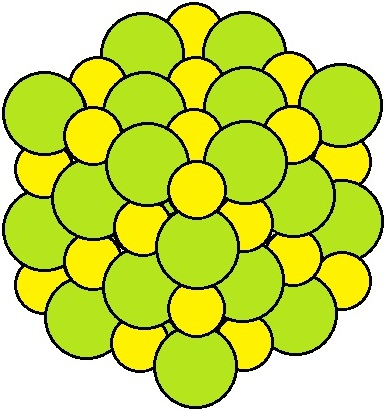 塩化ナトリウムの結晶は,拡大すると右図のようなモデルで表される構造をしています。ナトリウムイオンNa+と塩化物イオンCl-は互いに静電気力で引き合っています(イオン結合)。このような,イオン結合でできている結晶をイオン結晶といいます。
塩化ナトリウムの結晶は,拡大すると右図のようなモデルで表される構造をしています。ナトリウムイオンNa+と塩化物イオンCl-は互いに静電気力で引き合っています(イオン結合)。このような,イオン結合でできている結晶をイオン結晶といいます。
基本的に,イオン結晶は「金属元素」と「非金属元素」の両方で構成されています。ただし,塩化アンモニウムNH4ClなどのアンモニウムイオンNH4+を含む物質は非金属元素だけで構成されていますが,イオン結晶として存在しています。
陽イオンと陰イオンはイオン結合で結びついていますが,1個ずつで引き合っているのではありません。1つの陽イオンは周囲の複数の陰イオンと引き合っています。もちろん,1つの陰イオンも周囲の複数の陽イオンと引き合っています。
また,塩化ナトリウムとは違う構造をしたイオン結晶も存在しています。結晶の構造は,陽イオンや陰イオンの大きさ,イオンの価数などで決まります。
組成式
塩化ナトリウムの結晶の中には,ナトリウムイオンNa+と塩化物イオンCl-が同じ数だけ含まれています。例えば,1 gの塩化ナトリウムNaClの結晶があると,その中には約1022個のNa+とCl-がそれぞれ含まれています。しかし,Na10000000000000000000000Cl10000000000000000000000とは書きません。
この結晶を砕くと,ひと塊に含まれているNa+やCl-の数は変わってしまいます。しかし,塩化ナトリウムとしての性質は同じです。また,個数の比は1:1で変わりません。そのため,イオン結晶を化学式であらわすときには,最も簡単な整数比で表すことになっています。このような表し方をする化学式を,組成式といいます。通常,陽イオンとなっている元素を先に書きます。
陽イオンと陰イオンの数は,電気的に中性になるような比で含まれています。例えば,カルシウムイオンCa2+と塩化物イオンCl-でできている塩化カルシウムの組成式は,CaCl2です。1個当たりの電荷はCl-がCa2+の半分しかありません。Cl-の数が2倍になることで,プラスマイナス0になるのです。
多原子イオンが含まれる場合は,その他原子イオンの構成元素を( )でまとめます。例えば,硫酸アルミニウムはアルミニウムイオンAl3+と硫酸イオンSO42-からできています。イオンの価数の絶対値を最小公倍数の「6」に合わせることで,電気的に中性になりますので,Al3+が2に対してSO42-は3必要です。よって,組成式はAl2(SO4)3となります。
イオン結晶の性質
イオン結合は比較的強い結合です。そのため,イオン結晶の融点や沸点は高い傾向にあります。例えば,金属であるナトリウムの単体Naの融点は98℃ですが,イオン結晶である塩化ナトリウムNaClの融点は801℃です。
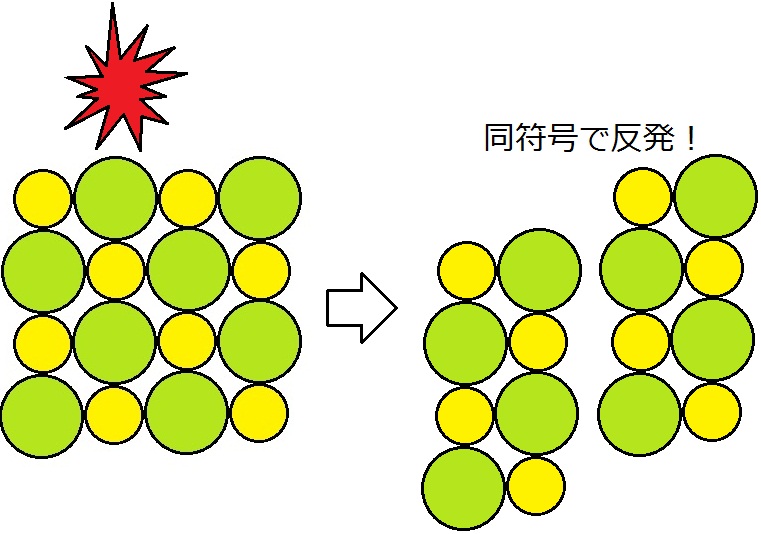
一方,物理的な衝撃で割れやすい性質があります。これは,衝撃により陽イオンと陰イオンの位置がずれると,陽イオンどうし,陰イオンどうしの反発しあう力が働くためです。
水に溶けやすいものがあるというのもイオン結晶の代表的な性質です。他の種類の結晶は,ほとんど水に溶けません。ただし,イオン結晶の中にも塩化銀AgClや硫酸バリウムBaSO4,炭酸カルシウムCaCO3などのように水溶性の低い物質もあります。
電気伝導性にも特徴があります。固体のイオン結晶では,陽イオンと陰イオンが規則正しく並んだ状態で固定されています。電圧をかけても,動くことはできません。そのため,イオン結晶の固体は電気を導きません。
しかし,熱を加えて融解し,液体の状態にすることで陽イオンや陰イオンが動ける状態になります。例えば,塩化ナトリウムを801℃以上に加熱すると,融解して液体になります。このような液体のイオン結晶は,電気を導きます。
また,イオン結晶を水に溶かすことでも陽イオンや陰イオンが動ける状態になります(電離)。そのため,イオン結晶の水溶液も電気を導きます。
スポンサーリンク
イオン結晶の利用
イオン結晶は,次のような性質や用途があります。
| 物質名 | 組成式 | 性質や用途 |
|---|---|---|
| 塩化ナトリウム | NaCl | 食塩の主成分です。 |
| 炭酸ナトリウム | Na2CO3 | ガラスの原料として利用されています。 空気中で水和水を失います(風解)。 Na2CO3・10H2O→Na2CO3・H2O |
| 炭酸水素ナトリウム | NaHCO3 | 重曹,ベーキングパウダー,胃薬,発泡入浴剤に利用されています。 |
| 水酸化ナトリウム | NaOH | 空気中の水分を吸収する(潮解)性質があります。 セッケンの製造などに利用されています。 |
| 塩化カルシウム | CaCl2 | 乾燥剤や凍結防止剤として利用されています。 |
| 炭酸カルシウム | CaCO3 | 石灰石,大理石,貝殻,卵殻の主成分です。 |
| 硫酸カルシウム | CaSO4 | ギプスや建築材料,塑像に利用されています。 |
| 水酸化カルシウム | Ca(OH)2 | 消石灰ともよばれています。 飽和水溶液は石灰水です。 漆喰(白い壁)の材料として利用されています。 |
| 酸化カルシウム | CaO | 生石灰ともよばれています。 乾燥剤や発熱剤として利用されています。 |
| 硫酸バリウム | BaCO4 | レントゲン写真の造影剤として利用されています。 |
スポンサーリンク