「水素イオン濃度とpH」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸と塩基の反応 > 水素イオン濃度とpH
水の電離
塩化水素などの酸やアンモニアなどの塩基,塩化ナトリウムなどのイオン結晶は,水に溶けて陽イオンや陰イオンを生じます。このように,水に溶けてイオンを生じる現象を電離といいます。
電離は,実は水自身にも起こっています。
H2O → H+ + OH-
このとき,化学反応式の係数から,H+とOH-の物質量〔mol〕は等しくなります。そのモル濃度は温度によって変化しますが,25℃のとき[H+]=[OH-]=1.0×10-7mol/Lであることがわかっています。
おまけ話
普段はあまり考えませんが,純粋な水についてもモル濃度や電離度を求めることができます。
純粋な水1L(1000cm3)は,1000gです。分子量H2O=18より,水1000gの物質量は,
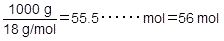
よって,モル濃度〔mol/L〕は次のようになります。
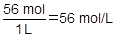
また,電離度について同じく水1Lで考えると,25℃では[H+]=1.0×10-7mol/Lです。ここに含まれる水素イオンの物質量が1.0×10-7molなので,電離した水分子の物質量も1.0×10-7molであることがわかります。
よって,25℃における水の電離度は次のように考えられます。
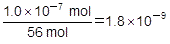
スポンサーリンク
水素イオン濃度と水素イオン指数pH
酸性を示す原因が水素イオン(オキソニウムイオン)であることをすでに学習しています。水溶液における水素イオンのモル濃度[H+]が大きいほど,酸性が強いということができます。
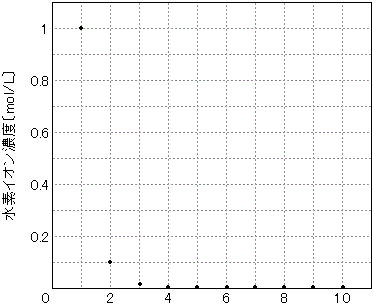
ただ,実験で扱うような水溶液の水素イオン濃度は,非常に広い範囲にわたって変化します。これをグラフで表そうとすると,低濃度のところの変化が見えてきません。
たとえば,次のグラフのように,水素イオン濃度を1mol/Lから10で割った点を書いていきます。すると,4点目辺りから読み取れなくなってしまいます。これは0.001mol/Lということになりますが,25℃において水の電離で生じた[H+]=1.0×10-7mol/Lの10000倍のモル濃度です。
中和の実験では,水素イオン濃度が10-1~10-13mol/L程度の水溶液を扱います。水素イオン濃度をグラフで表すときには,別の表現をする必要があるということです。
そこでよく用いられるのが水素イオン指数pH(ピーエイチ)です。これは,数学で習う「対数」と呼ばれるものを使っているのですが,化学基礎の中では次のように考えてください。
[H+]=1.0×10-n mol/L と表したとき,pHはnである。
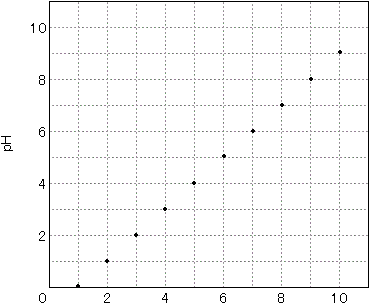
先ほどのように,水素イオン濃度を1mol/Lから10で割ったもののpHをまとめると,次の表や下のグラフのようになります。
| モル濃度〔mol/L〕 | 1(10-0) | 0.1(10-1) | 0.01(10-2) | 10-3 | 10-4 | 10-5 |
|---|---|---|---|---|---|---|
| pH | 0 | 1 | 2 | 3 | 4 | 5 |
| モル濃度〔mol/L〕 | 10-6 | 10-7 | 10-8 | 10-9 | 10-10 | 10-11 |
| pH | 6 | 7 | 8 | 9 | 10 | 11 |
このように,pHを用いると幅広い水素イオン濃度についてのグラフをつくることができるので便利です。
ちなみに,教科書や参考書ではpHは0~14までしかないように書かれています。しかし,実際には負の値や14よりも大きいpHの水溶液も存在しています。
また,水酸化物イオンのモル濃度[OH-]を用いたpOHというものもあります。
[OH-]=1.0×10-n mol/L と表したとき,pOHはnである。
25℃における水溶液では, pH+pOH=14 が成り立ちます。
液性
水溶液中の水素イオンと水酸化物イオンのモル濃度は,どちらも0mol/Lになることはありません。どちらのイオンも,必ず少しは存在しています(計算時には,ほぼ0mol/Lとして扱うことがあります)。
そこで,[H+]と[OH-]を比較して,水溶液の液性は次のように定義されています。
- [H+]=[OH-]となっている水溶液の液性は中性
- [H+]>[OH-]となっている水溶液の液性は酸性
- [H+]<[OH-]となっている水溶液の液性は塩基性
特に指定されていなければ,水溶液の温度は25℃と考えて構いません。25℃では,中性の水溶液のpHは7です。pHが7よりも小さければ酸性,7よりも大きければ塩基性です。
おまけ話
酸性雨という言葉があります。しかし,酸性雨ではない雨も空気中の二酸化炭素が溶け込んでpHは7より小さくなっています。
では,酸性雨の基準は何なのでしょうか。
空気中の二酸化炭素が水に溶けると,pHは5.6になります。二酸化炭素以外の原因が加わることで,pHは5.6よりも小さくなります。
一般的には,SO2などの硫黄酸化物やNO2などの窒素酸化物が空気中に排出されると,雨水のpHが5.6よりも小さい酸性雨となります。
酸性雨は,動植物や土壌,建造物への影響が懸念されています。
スポンサーリンク