「酸化・還元の定義」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸化還元反応 > 酸化・還元の定義
酸素原子の授受による酸化・還元の定義
中学生のときに,「酸素と化合するから酸化」というように教わっているかと思います。この定義が最も単純でわかりやすいと思います。
たとえば,黒色の酸化銅(Ⅱ)CuOを加熱して水素H2の中に入れると,きれいな赤銅色になります。
CuO + H2 → Cu + H2O
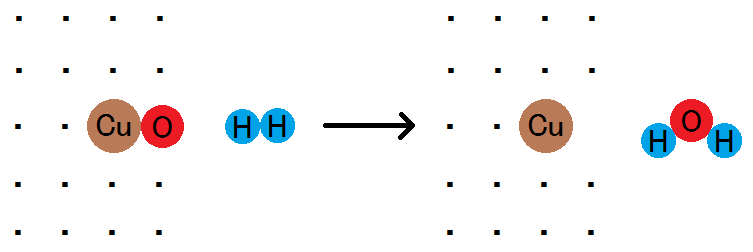
この反応において,水素が酸素原子を受け取っているので,「水素が酸化された」ということになります。
一方,酸化銅(Ⅱ)は,酸素原子を失っています。このとき,「酸化銅(Ⅱ)が還元された」ということになります。
このように,酸化と還元は同時に起こるため,全体としては「酸化還元反応」とよばれます。
スポンサーリンク
水素原子の授受による酸化・還元の定義
水素原子の受け渡しによっても,酸化・還元を定義することができます。
水素原子は陽イオンになりやすく,酸素原子は陰イオンになりやすい等,水素原子は酸素原子の逆の性質をもっていると考えられます。そのため,酸化と還元の関係も酸素とは逆になります。
酸素原子を受け取ると酸化されたことになるので,水素原子を受け取ると還元されたことになります。また,酸素原子を失うと還元されたことになるので,水素原子を失うと酸化されたことになります。
たとえば,硫化水素H2Sと酸素O2を混合したものに点火すると,容器の内壁に硫黄Sの細かい粒が付着します。
2H2S + O2 → 2S + 2H2O
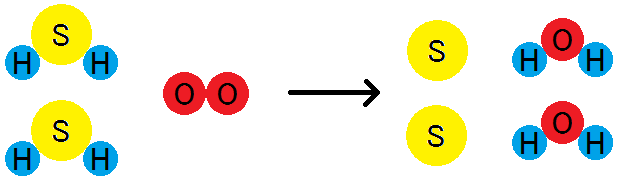
この反応において,酸素が水素原子を受け取っているので,「酸素が還元された」ということになります。
一方,硫化水素は,水素原子を失っています。このとき,「硫化水素が酸化された」ということになります。
もちろん,これは酸素原子の授受による定義と矛盾しません。硫化水素は酸素と反応しているので,確かに酸化されています。
電子の授受による酸化・還元の定義
マグネシウムMgなどの金属は,燃焼すると酸化物を生じます。
2Mg + O2 → 2MgO
この反応で生じた酸化マグネシウムMgOは,金属元素と非金属元素からなる化合物なのでイオン結晶です。これは,陽イオンと陰イオンで構成されているということです。
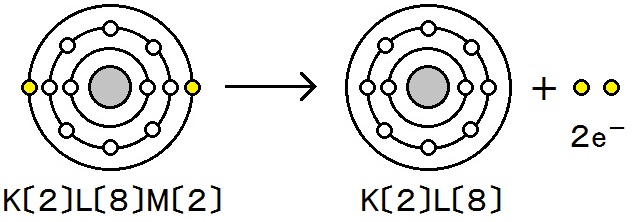
マグネシウムは電子e-を失ってマグネシウムイオンになっています。
Mg → Mg2+ + 2e-
また,酸素は電子を受け取って酸化物イオンになっています。
O2 + 4e- → 2O2-
(原子1個あたりでは O + 2e- → O2-)
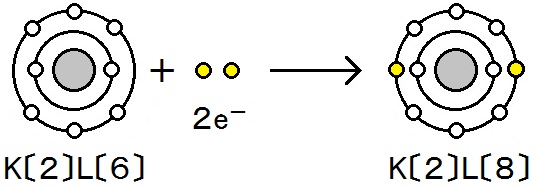
ここで,マグネシウムは酸化されていることから,電子を失うと酸化されたことになります。また,電子を受け取った酸素は還元されたことになります。
電子の授受による定義を用いると,酸素原子や水素原子がかかわらない反応についても酸化・還元を判断することができます。
たとえば,赤熱した同線を塩素Cl2の中に入れると,塩化銅(Ⅱ)CuCl2の褐色の煙を生じます。
Cu + Cl2 → CuCl2
CuCl2は金属元素と非金属元素からなる化合物なのでイオン結晶です。よって,陽イオンと陰イオンで構成されています。
Cu → Cu2+ + 2e-
Cl2 + 2e- → 2Cl-
(原子1個あたりでは Cl + e- → Cl-)
銅は電子を失っているので,酸化されたことになります。一方,塩素は電子を受け取っているので,還元されたことになります。
これまでの酸化還元の定義をまとめると,次の表のようになります。
| 酸素原子を | 水素原子を | 電子を | |
|---|---|---|---|
| 酸化された | 受け取った | 失った | 失った |
| 還元された | 失った | 受け取った | 受け取った |
スポンサーリンク