「電子配置」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 原子の構造と性質 > 電子配置
電子殻
原子核を取り巻く電子の数は,原子番号が大きくなるにつれて増えていきます。しかし,すべての電子が同じように存在しているわけではありません。実際には,数個の電子がグループをつくり,それぞれのグループに特有の軌道に分かれて運動しています。
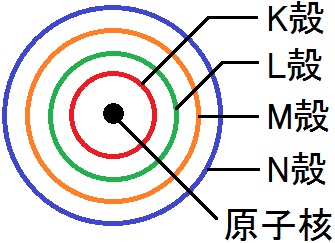 高校で学ぶ化学では,この軌道を層として考え,この層を電子殻とよんでいます。原子核に最も近い電子殻を「K殻」,その次の電子殻を「L殻」(以下アルファベット順)とよんでいます。
高校で学ぶ化学では,この軌道を層として考え,この層を電子殻とよんでいます。原子核に最も近い電子殻を「K殻」,その次の電子殻を「L殻」(以下アルファベット順)とよんでいます。
それぞれの電子殻は,収容できる電子の最大数が決まっています。その数は「2n2」で求めることができます。1番目のK殻には2×12=2個の電子が入ることができます。2番目のL殻には2×22=8個の電子が入ることができます。M殻には18個,N殻には32個の電子が入ります。
最大数まで電子が収容されている電子殻を,「閉殻」といいます。閉殻は非常に安定なので,化学反応に関わることはほとんどありません。
スポンサーリンク
電子配置
原子がもっている電子は,エネルギーが低くて安定な電子殻から順に配置されます。基本的には,内側のK殻から順に配置されると考えて構いません。
例えば,リチウム原子3Liは原子番号3なので陽子数3です。原子の状態では電気的に中性なので,「陽子数=電子数」より,電子数3です。電子はK殻から順に配置されますが,K殻には2個までしか電子が入りません。残り1個の電子は,その次にエネルギーが低くて安定なL殻に入ります。よって,K〔2〕L〔1〕という電子配置となります。
ナトリウム原子11Naならどうでしょうか。先ほどと同様に考えると,電子数は11個です。そのうち2個はK殻に入ります。残りの9個のうち8個はL殻に入ります。残った1個がM殻に入ります。よって,K〔2〕L〔8〕M〔1〕という電子配置となります。
オクテット則
電子配置を考えるとき,原子番号19のカリウムK以降は注意が必要です。M殻の最大電子収容数は2×32=18個ですが,実はこの18個の電子もいくつかのグループに分かれています。同様に,N殻以降の電子もいくつかのグループに分かれているのです。
先ほど,「電子はエネルギーが低くて安定な電子殻から順に配置される」と書きましたが,M殻以降は単純に内側から電子が配置されるわけではないのです。
基本的には,8個の電子を配置した後は,1つ外側の電子殻に電子が収容されます。例えば,カリウム原子19Kの電子配置を考えます。19個の電子のうち,2個はK殻,8個はL殻に入ります。残った9個のうち8個がM殻に入ります。M殻にはまだ空きスペースがありますが,次のN殻中の1グループの方がエネルギーが低くて安定なので,N殻に電子が1個入るのです。よって,K〔2〕L〔8〕M〔8〕N〔1〕という電子配置になります。
このように,電子を収容するスペースがあるにもかかわらず,8個の電子が配置されることによって安定になり,次の電子が外側の電子殻に配置されることを「オクテット則」といいます。8個の電子が配置されている状態は非常に安定なのですが,最大数まで配置されているわけではありませんので閉殻ではありません。
ちなみに,原子番号21のスカンジウムSc以降は遷移元素という分類の元素が続きます。遷移元素の電子配置は非常に複雑なので,出題されることはないと考えていいでしょう。
スポンサーリンク