「周期表」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 原子の構造と性質 > 周期表
周期表
元素を原子番号(陽子数)の順に並べると,化学的・物理的な性質が変化していき,性質のよく似た元素が周期的に現れます。このような規則性を元素の周期律といいます。また,周期的に現れる性質のよく似た元素を縦に並べたものが周期表です。
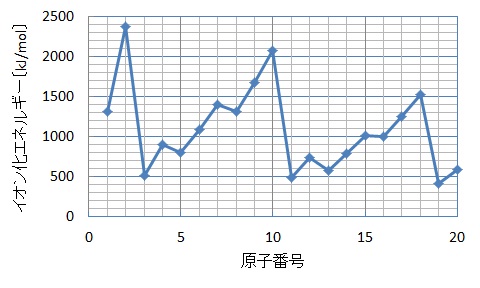
元素の周期律を示す性質としてよく登場するのは,「価電子数」,「第一イオン化エネルギー」などがあります。第一イオン化エネルギーについては,「イオン」に関するページで学習します。
おまけ話
周期表の原型は,ロシアのメンデレーエフによって作成されました。当時は原子量の順に元素を並べていたので誤りがありました。しかし,陽子数の順に並べることや希ガス元素の発見によって,誤りは解消されました。
| 元素 | エカケイ素Es | ゲルマニウムGe |
|---|---|---|
| 原子量 | 72 | 72.64 |
| 密度 | 5.5g/cm3 | 5.32g/cm3 |
| 色 | 灰色 | 灰白色 |
| 酸化物 | EsO2 | GeO2 |
| 塩化物 | EsCl4 | GeCl4 |
| 塩化物の沸点 | 100℃以下 | 83.1℃ |
| 融点の密度 | 1.9g/cm3 | 1.88g/cm3 |
メンデレーエフの周期表が画期的だったのは,未発見の元素を空欄にし,その性質を予言したことです。例えば,ケイ素Siの下にくる元素(ゲルマニウムGe)は発見されていませんでしたが,エカケイ素Esとして予測した性質がゲルマニウムGeとよく一致していたのです。
スポンサーリンク
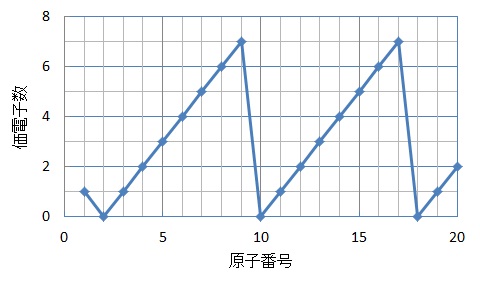
価電子
原子がイオンになったり原子どうしが結合したりするときには,一番外側の電子殻にある電子(最外殻電子)が重要なはたらきを示します。これは,最外殻電子(負電荷)は原子核(正電荷)から離れているので引力が弱いこと,一番外側にあるので他の原子からの影響が大きいことなどが原因です。
このように,重要なはたらきを示す電子を価電子といいます。たとえば,炭素原子6C電子配置はK〔2〕L〔4〕です。最外殻であるL殻に配置されている4個の電子が価電子です。価電子の数が同じである元素は,互いに性質が似ています。
注意すべきなのは,最外殻であっても安定な状態にある電子は価電子とよばないことです。たとえば,アルゴン原子18Arの電子配置はK〔2〕L〔8〕M〔8〕です。閉殻となっているK殻とL殻はもちろん安定ですが,最外殻のM殻もオクテット則により非常に安定です。よって,アルゴン原子Arの価電子の数は8個ではなく「0個」なのです。
スポンサーリンク