「元素の分類」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 原子の構造と性質 > 元素の分類
アルカリ金属
周期表の1族元素(左端の元素)は,すべて価電子の数が1個です。そのため,似たような性質をもっています。水素Hは金属ではないのでグループから外れますが,その他のリチウムLi,ナトリウムNa,カリウムK,ルビジウムRb,セシウムCs,フランシウムFrを総称してアルカリ金属といいます。
アルカリ金属の主な性質は次の通りです。
- 1価の陽イオンになりやすい。
- 空気や水と容易に反応するので,石油中(灯油中)に保存する。
- 沈殿をつくらない。
- 炎色反応を示す。
- 水酸化物は強塩基である。
アルカリ金属土類
周期表の第2族元素(左から2番目)は,すべて価電子の数が2個です。似たような性質をもっていますが,ベリリウムBeとマグネシウムMgは性質の異なることが多いため,グループから外れます。その他のカルシウムCa,ストロンチウムSr,バリウムBa,ラジウムRaを総称してアルカリ土類金属といいます。
アルカリ土類金属の主な性質は次の通りです。
- 2価の陽イオンになりやすい。
- 硫酸イオンSO42-と沈殿をつくる。(BeとMgの硫酸塩は水に溶ける。)
- 炎色反応を示す。(BeとMgは炎色反応を示さない。)
- 冷水と反応して水素H2を発生する。(BeやMgは温度が高くないと,水と反応しない。)
- 水酸化物が強塩基である。(BeやMgの水酸化物は弱塩基である。)
ハロゲン
周期表の17族元素(右から2番目)は,すべて価電子の数が7個です。そのため,似たような性質をもっています。フッ素F,塩素Cl,臭素Br,ヨウ素I,アスタチンAtを総称してハロゲンといいます。
ハロゲンの主な性質は次の通りです。
- 1価の陰イオンになりやすい。
- 単体が二原子分子である。
- 原子価が1である。
- 酸化力をもち,有毒である。
希ガス
周期表の18族元素(右端の元素)は,すべて価電子の数が0個です。そのため,似たような性質をもっています。ヘリウムHe,ネオンNe,アルゴンAr,クリプトンKr,キセノンNe,ラドンRnを総称して希ガスといいます。
希ガスの主な性質は次の通りです。
- 非常に安定である。そのため,イオンや化合物をつくりにくい。
- 単原子分子である。
スポンサーリンク
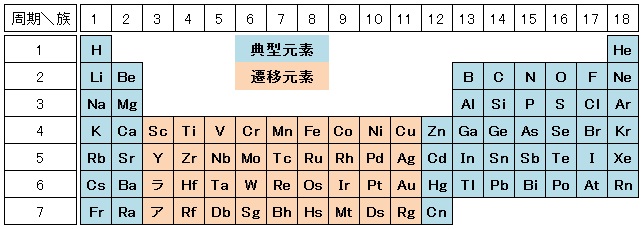
典型元素と遷移元素
3~11族の元素を遷移元素といいます。それ以外の1,2,12~18族の元素を典型元素といいます。周期表で凹んでいるところ全てが遷移元素という誤ったイメージをもつ生徒が多いのですが,凹んだ部分の右端にあたる12族は典型元素です。
典型元素のブロックでは,原子番号の増加にともなって増加する電子が「最外殻に配置」されます。そのため,価電子が1つずつ増えていきます(17族から18族は,価電子数は7→0になります)。同族元素で価電子数が等しいので,同族元素の性質はよく似ています。
一方,遷移元素のブロックでは,内側の電子殻に電子が移っていきます。そのため,最外殻電子は増えません。価電子数が1個または2個に保たれるので,原子番号が増加しても化学的な性質はあまり変化しません。典型元素とは異なり,同族元素(縦の並び)というよりは同周期(横の並び)の元素どうしがよく似た性質を示します。
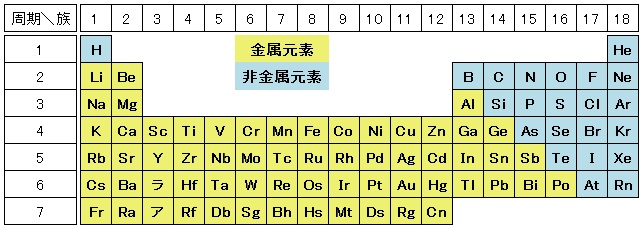
金属元素と非金属元素
単体が金属である元素と,そうでない元素に分類することができます。遷移元素はすべて金属元素です。
金属元素の主な特徴は次の通りです。
- 陽イオンになりやすい(陽性,金属性)。
- 単体は,金属光沢を示す。
- 単体は,導電性や熱伝導性が高い。
- 単体は,展性・延性を示す。
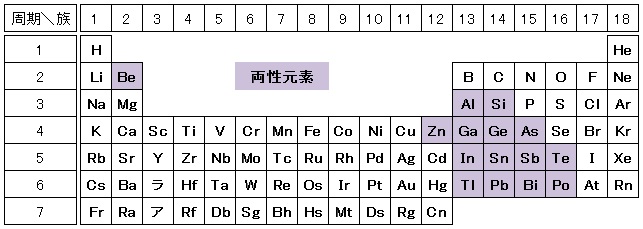
両性元素
金属元素の中には,塩酸とも水酸化ナトリウム水溶液とも反応する元素があります。このように,酸ともアルカリとも反応する元素を両性元素といいます。周期表では,両性元素は金属元素と非金属元素の境界付近にあります。
代表的な両性元素には,アルミニウムAl,亜鉛Zn,スズSn,鉛Pbがあり,「あ あ すん なり」という語呂で覚えられます。
ちなみに,両性元素はすべて典型元素です。遷移元素には両性元素は存在しません。
スポンサーリンク