「電気陰性度と極性」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 化学結合と結晶 > 電気陰性度と極性
電気陰性度
共有結合している2つの原子の間には,共有電子対があります。ただ,この共有電子対は,2つの原子の真ん中にあるとは限りません。それぞれの原子には共有電子対を引き寄せる力があり,その力の大きい方の原子に寄っているのです。
この「共有電子対を引き寄せる力」のことを電気陰性度といいます。電気陰性度は,周期表の希ガスを除いた右上ほど大きい傾向があり,フッ素Fが最大です。
結合の極性
共有結合している2つの原子に電気陰性度の違いがあると,共有電子対は電気陰性度の大きい方に引きつけられています。電子は負の電荷をもっていますから,共有電子対を引きつけた方の原子は,少しだけ負が強くなります。一方,電気陰性度が小さい原子からは共有電子対が離れていきますが陽子は元のまま残るので,少しだけ正が強くなります。
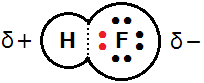
例えば,フッ化水素HFは水素原子とフッ素原子が単結合でつながっています。電気陰性度はフッ素原子の方が大きいので,共有電子対はFの方に引き寄せられています(図中の点線よりも赤い電子対がFに寄っている)。その結果,電子が近付いたFの方がδ-(少しだけ負)となり,電子が離れたHの方がδ+(少しだけ正)となります。このプラスとマイナスの偏りが,結合の極性です。
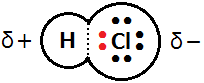
原子間の電気陰性度の差が大きいほど,極性は大きくなります。H-Cl(3.2-2.2=1.0の差)の極性は,H-F(4.0-2.2=1.8の差)の極性よりも小さいのです。
ただし,電荷の偏りを表すδ+やδ-は,あくまで「少しだけ」プラスやマイナスであるということなので,具体的な値を意味していません。よって,極性の大きさは違いますが,H-ClでもH-Fでもδ+やδ-を用いて極性を表します。

スポンサーリンク
分子の極性
H-FやH-Clは,分子の中に共有結合は1ヶ所しかありません。二酸化炭素CO2のように2ヶ所以上の共有結合をもつ分子の場合,それぞれの共有結合が極性をもちます。
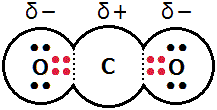
炭素原子Cと酸素原子Oでは,Oの電気陰性度の方が大きいので,共有電子対はOの方に近づいています。これは,Cに対して左側のOだけではなく,右側のOに対しても同様です。ちなみに,δ+やδ-は量的な関係を表しませんので,2δ+という表し方はしません。
ここで,二酸化炭素分子全体の極性を考えます。共有結合が2ヶ所あるので,結合の極性は2ヶ所です。この2つの結合の極性は,「一直線状」にあり,「逆向き」で,どちらもCとOの電気陰性度の差ですから「同じ大きさ」の極性です。よって,(力のつり合いと同様に)2つの極性が打ち消し合います。このように,分子全体として極性がなくなる場合,その分子を無極性分子といいます。
また,水素分子H2のように同じ原子が共有結合している場合は,共有電子対が原子間の中央にあるので結合の極性がありません。もちろんこの場合も分子全体には極性がありませんから,水素分子H2は無極性分子です。
気を付けたいのが,分子の形のせいで極性が打ち消し合わない場合です。その代表例が水分子H2Oです。一見,二酸化炭素CO2と同じように考えてしまいがちですが,水分子H2Oは折れ線形をしています。
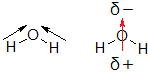
左側の構造式では,結合の極性を表しています。左右の向きで考えれば打ち消し合うのですが,上下の向きでは「上向き」に足し合わされます。その結果,右側の構造式に赤色の矢印で示したような,酸素原子側がδ-,水素原子側がδ+となる極性が残ります。よって,水分子H2Oは極性分子です。
代表的な分子についてまとめると,次の表のようになります。
| 物質 | 水H2O | 二酸化炭素CO2 | アンモニアNH3 | メタンCH4 |
|---|---|---|---|---|
| 構造式 | 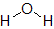 | 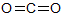 | 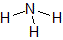 | 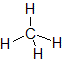 |
| 分子の形 | 折れ線形 | 直線形 | 三角錐形 | 正四面体形 |
| 分類 | 極性分子 | 無極性分子 | 極性分子 | 無極性分子 |
一般に,極性分子は無極性分子に比べて,水に溶けやすい傾向があります。また,極性分子の方が,沸点が高くなります(他の要素も関わってきます)。
スポンサーリンク
