「原子の質量と相対質量」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 物質量と化学反応式 > 原子の質量と相対質量
原子の質量
原子1個の質量は,10-24g~10-22g程度です。これらの数字が非常に小さいため,実験準備やデータ処理などで複雑になってしまいます。
とくに覚える必要はありませんが,代表的な原子の1個当たりの質量をまとめておきます。
| 元素 | 原子 | 質量〔g〕 |
|---|---|---|
| 水素 | 1H | 1.6735×10-24 |
| 2H | 3.3445×10-24 | |
| ヘリウム | 4He | 6.6465×10-24 |
| 炭素 | 12C | 1.9926×10-23 |
| 13C | 2.1593×10-23 | |
| 窒素 | 14N | 2.3253×10-23 |
| 15N | 2.4908×10-23 | |
| 酸素 | 16O | 2.6560×10-23 |
| 17O | 2.8228×10-23 | |
| 18O | 2.9888×10-23 | |
| ナトリウム | 23Na | 3.8175×10-23 |
| アルミニウム | 27Al | 4.4805×10-23 |
| 塩素 | 35Cl | 5.8067×10-23 |
| 37Cl | 6.1383×10-23 | |
| アルゴン | 36Ar | 5.9726×10-23 |
| 38Ar | 6.3039×10-23 | |
| 40Ar | 6.6359×10-23 | |
| カリウム | 39K | 6.4701×10-23 |
| 40K | 6.6362×10-23 | |
| 41K | 6.8019×10-23 | |
| ウラン | 238U | 3.9528×10-22 |
スポンサーリンク
相対質量
上に書いたように,原子1個の質量は非常に小さいので,実験で量り取るときなどに扱いづらいことがあります。そこで,異なる原子間の質量比は崩すことなく簡単な数値として扱うために,相対質量というものを用いるようになりました。
これまで基準はコロコロ変わっていますが,現在は「質量数12の炭素原子12Cをちょうど12とする」を基準にしています。そして,12Cとの質量比を考慮して他の原子の相対質量を求めることにしています。
例えば,理解しやすくするために有効数字2桁で考えると,12Cの質量は2.0×10-23g,18Oの質量は3.0×10-23gです。
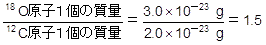
より,18Oの質量は,基準である12Cの質量の1.5倍です。よって,18Oの相対質量は基準である「12」の1.5倍で18ということになります。
逆のパターンを考えてみます。相対質量が9.0である原子の絶対質量を求めてみましょう。この原子の相対質量は,基準である12C(相対質量12)の0.75倍です。つまり,絶対質量も12Cの0.75倍ということになります。よって,2.0×10-23g×0.75=1.5×10-23gです。
代表的な原子の相対質量を求めると,次のようになります。
| 元素 | 原子 | 質量〔g〕 | 相対質量 | 質量数 |
|---|---|---|---|---|
| 水素 | 1H | 1.6735×10-24 | 1.0078 | 1 |
| 2H | 3.3445×10-24 | 2.0141 | 2 | |
| ヘリウム | 4He | 6.6465×10-24 | 4.0026 | 4 |
| 炭素 | 12C | 1.9926×10-23 | 12 | 12 |
| 13C | 2.1593×10-23 | 13.003 | 13 | |
| 窒素 | 14N | 2.3253×10-23 | 14.003 | 14 |
| 15N | 2.4908×10-23 | 15.000 | 15 | |
| 酸素 | 16O | 2.6560×10-23 | 15.995 | 16 |
| 17O | 2.8228×10-23 | 16.999 | 17 | |
| 18O | 2.9888×10-23 | 17.999 | 18 | |
| ナトリウム | 23Na | 3.8175×10-23 | 22.990 | 23 |
| アルミニウム | 27Al | 4.4805×10-23 | 26.982 | 27 |
| 塩素 | 35Cl | 5.8067×10-23 | 34.969 | 35 |
| 37Cl | 6.1383×10-23 | 36.966 | 37 | |
| アルゴン | 36Ar | 5.9726×10-23 | 35.968 | 36 |
| 38Ar | 6.3039×10-23 | 37.963 | 38 | |
| 40Ar | 6.6359×10-23 | 39.962 | 40 | |
| カリウム | 39K | 6.4701×10-23 | 38.964 | 39 |
| 40K | 6.6362×10-23 | 39.964 | 40 | |
| 41K | 6.8019×10-23 | 40.962 | 41 | |
| ウラン | 238U | 3.9528×10-22 | 238.05 | 238 |
質量数12の炭素原子12Cを基準の12とおくことで,他の原子についても質量数と相対質量がほぼ同じ値になっています。よって,質量数が原子の相対質量の目安になりますが,定義は全く違いますので混同しないように整理しておきましょう。
ここで,相対質量について気を付けたい点が2つあります。
1つは,相対質量には単位がないということです。相対質量はあくまでも「比」なので,kgやgという単位をつけるとおかしくなります。
もう1つは,原子などの粒子1個についての値だということです。あとで「物質量」というものを学習すると,そこでは多数の粒子を集めたときの質量を考えることになります。そのときに混同してしまうことがありますので,気を付けてください。
スポンサーリンク