「物質量と質量」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 物質量と化学反応式 > 物質量と質量
物質量と質量
化学反応式は,その係数が数(物質量)の関係を表していることを前のページで確認しました。しかし,実際に実験するときには電子天秤などで質量〔g〕を量ります。
相対質量や物質量は「質量数12の炭素原子12C」が基準となっていたので,これを例にとって物質量〔mol〕と質量〔g〕の関係を考えていきます。
物質量の定義は,「質量数12の炭素原子12Cを12g集めたときに存在している原子の数を1molとする」というものです。これを逆から読み取ると,「質量数12の炭素原子12Cを1mol集めると12gになる」ということです。
また,相対質量も12Cを基準の「12」としています。よって,「相対質量12の炭素原子12Cを1mol集めると12gになる」と言い換えることもできます。
相対質量のページで例として扱った質量数18の酸素原子18Oの相対質量は「18」でした。これらを比較して18Oの質量は12Cの質量の1.5倍です(相対質量なので1個当たりの質量の比較)。
1個当たりの質量が1.5倍のものを同じ数だけ集めると,総質量も1.5倍になるはずです。よって,相対質量が18の酸素原子18Oを1molだけ集めると,その質量は12g×1.5=18gです。
他の相対質量の原子で同様に考えても,物質量が1molのときの質量は「相対質量」と必ず同じ値になります。
物質量(数)が2倍,3倍,・・・・・・となれば質量も2倍,3倍,・・・・・・となるので,物質量〔mol〕と質量〔g〕は比例関係になっています。物質量をn〔mol〕,相対質量をM,質量をw〔g〕とおくと,
1mol : M〔g〕 = n〔mol〕 : w〔g〕
よって, w = n × M , n = 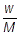 , M =
, M = 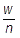
スポンサーリンク
原子量・分子量・式量と質量
原子量や分子量・式量は,原子や分子,組成式に相当する原子やイオンの相対質量(天然存在比を考慮した平均値)です。原子や分子,イオンなどを1mol集めると,原子量や分子量・式量と同じ値の質量になるはずです。
- 炭素の原子量は12.01 ⇔ 炭素原子1molの質量は12.01g
- 水H2Oの分子量は18 ⇔ 水分子1molの質量は18g
- 塩化ナトリウムNaClの式量は58.5 ⇔ 塩化ナトリウム1molの質量は58.5g
- 硫酸イオンSO42-の式量は96 ⇔ 硫酸イオン1molの質量は96g
原子の相対質量と同様に,物質量をn〔mol〕,原子量・分子量・式量をM,質量をw〔g〕とおくと,次の比例関係の式が成り立ちます。
1mol : M〔g〕 = n〔mol〕 : w〔g〕
よって, w = n × M , n = 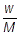 , M =
, M = 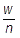
モル質量
1molあたりの質量〔g〕をモル質量といい,g/molの単位で表します。
- 質量数12の炭素原子12Cの相対質量は12 ⇔ 1molの12Cの質量は12g
- 炭素の原子量は12.01 ⇔ 炭素原子1molの質量は12.01g
- 水H2Oの分子量は18 ⇔ 水のモル質量は18g/mol
- 塩化ナトリウムNaClの式量は58.5 ⇔ 塩化ナトリウムのモル質量は58.5g/mol
- 硫酸イオンSO42-の式量は96 ⇔ 硫酸イオンのモル質量は96g/mol
モル質量〔g/mol〕は,単位に注目しながら式を立てるときに有効です。
g/mol は分数で表すと 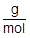 となります。
となります。
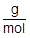 × mol = g より,モル質量〔g/mol〕に物質量〔mol〕を掛けることで,質量〔g〕を求めることができます(w = n × M)。
× mol = g より,モル質量〔g/mol〕に物質量〔mol〕を掛けることで,質量〔g〕を求めることができます(w = n × M)。
g ÷ 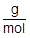 = mol より,質量〔g〕をモル質量〔g/mol〕で割ることによって,物質量〔mol〕を求めることができます(n =
= mol より,質量〔g〕をモル質量〔g/mol〕で割ることによって,物質量〔mol〕を求めることができます(n = 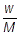 )。
)。
g ÷ mol = 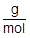 より,質量〔g〕を物質量〔mol〕で割ることによって,モル質量〔g/mol〕を求めることができます(M =
より,質量〔g〕を物質量〔mol〕で割ることによって,モル質量〔g/mol〕を求めることができます(M = 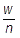 )。モル質量〔g/mol〕は原子量や分子量,式量〔単位なし〕と値が同じなので,モル質量を求めることによって原子量や分子量,式量を知ることができます。
)。モル質量〔g/mol〕は原子量や分子量,式量〔単位なし〕と値が同じなので,モル質量を求めることによって原子量や分子量,式量を知ることができます。
これらは非常に重要な計算になってきますので,しっかりと練習をして慣れておきましょう。
スポンサーリンク