「塩の加水分解」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸と塩基の反応 > 塩の加水分解
塩の加水分解(水溶液の液性)
塩の水溶液の液性が,酸性塩・塩基性塩・正塩の分類で決まるわけではありません。では,どのようにして水溶液の液性が判断できるのでしょうか。
実は,塩をつくる酸・塩基の強弱(電離度)で塩の水溶液の液性を判断することができるのです。
強酸・強塩基は,水溶液中では電離して単独のイオンとして存在してやすく,塩として存在しやすいといえます。一方,弱酸・弱塩基は,水溶液中で電離しにくく,イオンや塩として存在しにくいといえます。
弱酸が電離して生じた陰イオンの一部は,水素イオンと反応して元の酸に戻ります。このとき,水素イオンが減少するので,塩基性へと変化します。
CH3COO- + H+ → CH3COOH
一方,強酸が電離して生じた陰イオンは,水素イオンと反応して元の酸に戻るという反応がほとんど起こりません。強酸は,ほぼすべてが電離して単独のイオンとして存在してやすいからです。そのため,塩基性への変化はほとんど起こりません。
Cl- + H+ → ほとんど反応しない
同様に,弱塩基が電離して生じた陽イオンの一部は,水酸化物イオンと反応して元の塩基に戻ります。このとき,水酸化物イオンが減少するので,酸性へと変化します。
NH4+ + OH- → NH3 + H2O
ただし,弱塩基としてアンモニアを考える場合,「アンモニアが水分子に水素イオンを与えてオキソニウムイオンを生じるため酸性になる」と考えることが多いです。
NH4+ + H2O → NH3 + H3O+
強塩基が電離して生じた陽イオンは,水酸化物イオンと反応して元の塩基に戻るという反応がほとんど起こりません。強塩基は,ほぼすべてが電離して単独のイオンとして存在してやすいからです。そのため,酸性への変化はほとんど起こりません。
Na+ + OH- → ほとんど反応しない
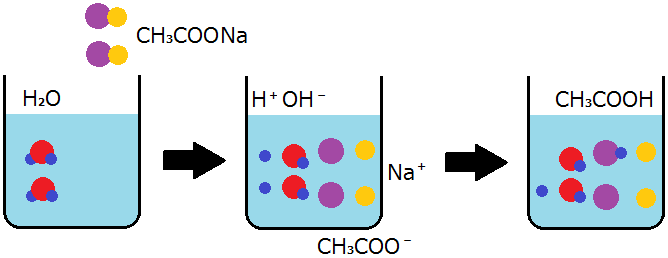
以上の内容をもとに,酢酸ナトリウムCH3COONa水溶液と塩化アンモニウムNH4Cl水溶液の液性をそれぞれ考えます。
酢酸ナトリウムは,次のように電離して酢酸イオンとナトリウムイオンを生じます。
CH3COONa → CH3COO- + Na+
酢酸イオンの一部は水素イオンと反応して弱酸の一つである酢酸に戻りますが,ナトリウムイオンは水酸化物イオンと反応して強塩基の一つである水酸化ナトリウムにはほとんど戻りません。
CH3COO- + H+ → CH3COOH
Na+ + OH- → ほとんど反応しない
H+とOH-は水の電離によって生じるイオンですから,2つの式を足し合わせて左辺の陽イオンと陰イオンを元の組合せで表すと,次の式で表すことができます。この式から,酢酸ナトリウム水溶液が塩基性であることがわかります。
CH3COONa + H2O → CH3COOH + Na+ + OH-
塩化アンモニウムは,次のように電離してアンモニウムイオンと塩化物イオンを生じます。
NH4Cl → NH4+ + Cl-
アンモニウムイオンの一部は水と反応して弱塩基の一つであるアンモニアに戻りますが,塩化物イオンは水素イオンと反応して強酸の一つである塩化水素にはほとんど戻りません。
NH4+ + H2O → NH
Cl- + H3O+ → ほとんど反応しない
H+とOH-は水の電離によって生じるイオンですから,2つの式を足し合わせて左辺の陽イオンと陰イオンを元の組合せで表すと,次の式で表すことができます。この式から,塩化アンモニウム水溶液が酸性であることがわかります。
NH4Cl + H2O → NH3 + H3O+ + Cl-
塩の水溶液の液性を判断するときには,元の酸・塩基の強弱を考えます。「塩の元の酸・塩基の強弱(電離度)に差がある場合,強い方の性質が表れる」というまとめ方が一般的です。
酢酸ナトリウムは酢酸(弱酸)と水酸化ナトリウム(強塩基)からなる塩で,その水溶液は塩基性です。塩化アンモニウムは塩化水素(強酸)とアンモニア(弱塩基)からなる塩で,その水溶液は酸性です。
スポンサーリンク
強酸と強塩基の塩
塩化ナトリウムのような強酸と強塩基の塩(塩化水素と水酸化ナトリウムの塩)は,陰イオン,陽イオンともに水素イオンや水酸化物イオンと反応せず,加水分解しません。
ただし,電離によって液性が変化して中性でない場合があります。
例えば,硫酸水素ナトリウムNaHSO4は硫酸(強酸)と水酸化ナトリウム(強塩基)から生じる塩です。もちろん加水分解しません。しかし,硫酸水素イオンHSO4-はさらに電離して水素イオンを生じます。その結果,液性は酸性となります。
HSO4- → H+ + SO42-
また,塩化水酸化カルシウムCaCl(OH)は塩化水素(強酸)と水酸化カルシウム(強塩基)から生じる塩です。加水分解しませんが,電離によって水酸化物イオンを生じるため,その水溶液は塩基性です。
CaCl(OH) → Ca2+ + Cl- + OH-
勘のいい人は察していると思いますが,強酸と強塩基の塩の場合だけ,酸性塩の水溶液は酸性,塩基性塩の水溶液は塩基性,正塩の水溶液は中性になります。
絶対に間違ってほしくないのですが,元の酸・塩基の強弱に差がある場合は,塩の分類(酸性塩・塩基性塩・正塩)で考える電離の影響よりも,上述の加水分解の方が影響は大きくなります。まずは,元の酸・塩基の強弱で判断してください。
スポンサーリンク