「中和滴定」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸と塩基の反応 > 中和滴定
中和滴定の標準溶液
前のページで中和の公式 a×c×v=a´×c´×v´ を導きました。中和滴定は,この公式を用いてモル濃度がわからない酸または塩基の水溶液のモル濃度を調べる操作です。
中和の公式において6つの文字のうち5つがわかっていれば,残りの1つを求めることができます。酸や塩基の種類が決まっていれば,酸・塩基の価数aとa´が決まります。酸・塩基の水溶液の体積vとv´は実験操作の中で決定します。
よって,酸の水溶液のモル濃度cを求めたければ,塩基の水溶液のモル濃度c´がわかっている必要があります。逆に,塩基の水溶液のモル濃度c´を求めたければ,酸の水溶液のモル濃度cがわかっている必要があります。
このように,他方の水溶液のモル濃度を求めるために用いる,濃度既知の水溶液を標準溶液といいます。
一般的に,酸の標準溶液としては,シュウ酸二水和物(COOH)2・2H2Oを用いて調製した水溶液を用います。これは,シュウ酸二水和物の純度が高く,空気中の酸素や二酸化炭素,水蒸気に対して反応しにくいなどの特長があるためです。
スポンサーリンク
中和滴定に用いる器具
詳しい実験の手順については,実験指針書のページをご覧ください。ここでは,試験で出題されそうな内容について書いていくことにします。
まずは,実験に用いる器具についてです。代表的な4つの器具の名称と形状,洗浄方法を整理し,中和滴定のどの操作で使用するのかをまとめておきましょう。
| 図 |  |  |  |  |
|---|---|---|---|---|
| 器具名と 洗浄法 | メスフラスコ 共洗いしない | ホールピペット 共洗いする | ビュレット 共洗いする | コニカルビーカー 共洗いしない |
共洗いは,次に使う水溶液で洗うという操作です。水で洗った器具の内壁には,水が残ります。ここに水溶液を入れると,水溶液の濃度が小さくなってしまいます。次に入れる水溶液で濡らしておくことで,濃度の変化を防ぐことができます。
シュウ酸二水和物の標準溶液を調製するときには,メスフラスコを用います。このとき,正確にはかり取ったシュウ酸二水和物を溶かし,メスフラスコに移してから水を加えて体積を合わせます。
調整前のメスフラスコの中にシュウ酸やその他の反応する物質が混入していると濃度が変わってしまいます。水でしっかりと洗浄する必要があります。ただし,洗浄後に水でぬれていても構いません。結局は体積を合わせるためにあとから水を加えるので,水が先に入っていても最終的には同じ状態になります。
水溶液の調整については,実験のページや溶液の濃度のページをご確認ください。
一定の体積の水溶液を取り出すときには,ホールピペットを用います。メスフラスコと同様に,標線まで水溶液を吸い上げます。ホールピペットの洗浄は共洗いです。水で濡れていると,その分だけ吸い上げた水溶液の体積が小さくなってしまいます。
中和滴定では,溶液の飛散や二酸化炭素などの影響を抑えるために,コニカルビーカーや三角フラスコなどの,口の狭い器具を用います。これらの器具は,水で洗って濡れたまま使用します。共洗いしてはいけません。
中和の公式は,「酸の水素イオンの物質量」と「塩基の水酸化物イオンの物質量」が等しいというものです。共洗いすると,ホールピペットで移した酸(または塩基)の量よりも多くなってしまいます。水で洗ったあとは,水で濡れていても酸(または塩基)の量は変わりません。
ビュレットは,滴下量の体積を測定する器具です。滴下前と滴下後の目盛の差が,滴下量となります。ビュレットは共洗いする器具です。水で濡れていると,水溶液の濃度が小さくなってしまいます。計算に用いる数値と異なってしまいますので,水で洗って濡れたまま使用してはいけません。
中和滴定曲線と指示薬の選択
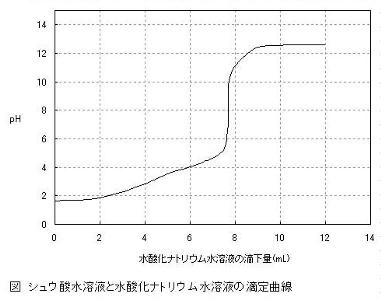
中和滴定では,ビュレットから水溶液を滴下するごとに,コニカルビーカーの水溶液のpHが変化していきます。中和が完了するところでpHが大きく変化(pHジャンプ)するので,この変化を数値や色の変化として読み取ります。
pHの値を記録して上図のような中和滴定曲線を作成するなら,指示薬は不要です。しかし,指示薬で中和点を判断する場合は,その選択が必要になります。これは,弱酸・弱塩基の電離度が小さいことや,塩の加水分解が原因です。
たとえば,上図はシュウ酸と水酸化ナトリウムの中和滴定曲線です。シュウ酸は弱酸であり,水酸化ナトリウムは強塩基です。
シュウ酸が弱酸なので, pHが比較的中性に近い値をとります。また,中和点では弱酸と強塩基の塩の水溶液なので,塩の加水分解により塩基性を示します。そのため,中和点までの中和滴定曲線が上にずれているような状態です。
ここで,指示薬を選択する必要が出てきます。
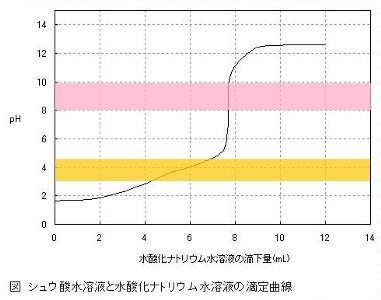
たとえば,メチルオレンジは酸性で赤色,中性・塩基性で黄色になります。ただし,酸性でも中性に近いところでは黄色です。具体的には,pH 3.1以下なら赤色,pH 4.4以上なら黄色で,pH 3.1~4.4では,徐々に色合いが変化していきます。このように,色合いが変化するpHの範囲を,変色域といいます。
ここで,先ほどの中和滴定曲線と照らし合わせてみると,中和点でpHが大きく変化する前に,色が変化していることが分かります。つまり,色が変化したときの滴下量(4.3mL~6.9mL)は,中和点の滴下量(7.69mL)よりも少ないのです。
一方,フェノールフタレインの変色域は,pH8.0~9.8です。中和点の滴下量と同じところで変色していることが分かります。よって,シュウ酸と水酸化ナトリウムの中和滴定では,メチルオレンジは指示薬としては不適切で,フェノールフタレインを用いるべきです。
先ほど書いたように,弱酸はpHが高くなって中性に近づいた状態になっています。メチルオレンジのように変色域が酸性側である指示薬は,弱酸を用いる中和滴定に適さないということがわかります。
また,弱塩基を用いた場合は,pHが低くなって中性に近づきます。フェノールフタレインのように変色域が塩基性である指示薬は,弱塩基を用いる中和滴定に適さないということが分かります。
スポンサーリンク