「原子の質量」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 原子の構造と性質 > 原子の質量
質量数
| 素粒子 | 質量〔g〕 | 質量比 |
|---|---|---|
| 陽子 | 1.673×10-24 | 1 |
| 中性子 | 1.675×10-24 | 1 |
| 電子 | 9.109×10-28 | 1/1840 |
原子には,質量があります。そして,そのほとんどが原子核に集中しています。素粒子1個当たりの質量を確認してみると,右の表のようになります。
陽子と中性子は,ほとんど質量が同じです。また,電子の質量は非常に小さく,この分を無視しても差し支えありません。
これらのことから,原子の質量は,陽子と中性子の総数に比例することがわかります。例えば,あるアルゴンAr原子には18個の陽子と22個の中性子が含まれています。また,あるカルシウムCa原子には20個の陽子と20個の中性子が含まれています。それぞれの質量を求めると,どちらも6.696×10-23gです。陽子数と中性子数の総和が40個である2つの原子は,その内訳が違ったとしても同じくらいの質量になるのです。
原子の質量が陽子と中性子の総数に比例するので,この総数を「質量数」とよんでいます。つまり,「質量数=陽子数+中性子数」です。
質量数を表す場合には,元素記号の左上に書きます。原子番号との記入場所を間違えることがよくあります。質量数は「原子番号+中性子数」なので,原子番号より下になることはありません。質量数は原子番号よりも上であると覚えておくといいでしょう。
例 : 12C ,238U
おまけ話
1903年,日本の長岡半太郎が「原子は,正電荷を帯びた粒子のまわりを,負電荷を帯びた電子が円軌道を描いて回っている。ちょうど太陽の周りを惑星が公転しているように。」という当時としては突拍子もない原子モデルを提唱しました。
1911年,イギリスのラザフォードが実験により原子の構造を確認したところ,長岡半太郎の原子モデルとよく一致することが確認されました。
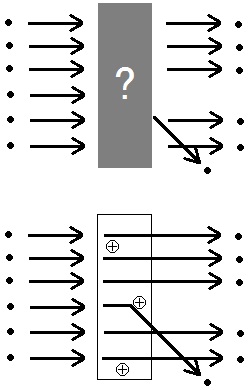
その実験は,うすい金箔にα粒子を照射するというものでした。ほとんどのα粒子は金箔を通り抜けましたが,ごく一部のアルファ粒子だけが何かに衝突して進む方向が大きく変わってしまいました。
進む方向が変化したところにしかα粒子が衝突するもの(陽子や中性子)がないということですから,原子のごく一部に陽子と中性子が集まっていることが確認されたのです。
ちなみに,原子の大きさ約10-10mに対して,原子核の大きさは約10-15mです。キリのいい数字なので覚えやすいですね。
スポンサーリンク
同位体
上述のように,陽子数や電子数が異なると,原子の化学的な性質は全く違うものになります。しかし,電荷をもたない中性子は,その数が変化しても原子の化学的な性質に影響を与えません。
例えば,水素原子には,1Hの他に2Hと3Hが存在しています。陽子の数はすべて1個なので,原子番号1の水素原子です。もちろん,化学的な性質はすべて同じです。しかし,中性子の数は0,1,2とすべて異なっているので,質量数が違います。このように,原子番号が同じで質量数の異なる原子を互いに同位体といいます。ちなみに,中性子をもたない原子は,1Hだけです。
よく,元素と原子の違いが分からないと言う生徒がいます。元素は種類を表すもので実体がありませんが,原子は粒子なので実体があります。また,同位体を考えれば違いは明白です。陽子数が同じなら中性子数が違っても同じ元素の原子です。陽子数が同じでも中性子数が異なれば違う原子(同位体)なのです。
放射性同位体
同位体の中には,原子核が不安定で放射線(高エネルギーの粒子や電磁波)を出しながら原子核が壊れていく(壊変または崩壊)ものがあります。このような同位体を,放射性同位体といいます。放射線と聞くと悪いイメージを抱きがちですが,実は広い分野に応用されています。
例えば,放射性同位体の14Cを用いた年代測定があります。炭素原子の同位体のうち,14Cは放射性同位体です。14Cは,自然界では生成による増加と壊変による減少のバランスが取れているので,常に一定の割合で大気中の二酸化炭素CO2に含まれています。
動植物が生存している間は,光合成や捕食により14Cを取り入れているので,体内には一定の割合の14Cが含まれています。しかし,遺体となった後は崩壊による減少のみが起こるので,14Cは減り続けます。
14Cは約5730年がたつと半分になります(半減期5730年)ので,14Cの割合から生存時の年代を測定することができるのです。つまり,14Cの割合が通常の半分なら5730年が経過していることになりますし,5730年×2=11460年が経過しているなら半分の半分で1/4になっているはずです。
スポンサーリンク