「金属と金属結合」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 化学結合と結晶 > 金属と金属結合
金属結合
一般に,金属元素は陽性が強い(つまりイオン化エネルギーが小さい)ため,価電子が離れやすい傾向があります。金属元素の原子が並んでいると,価電子は隣の原子の最外殻へと移りやすく,また別の原子の最外殻へと自由に動くことができます。このような電子を,自由電子といいます。
自由電子が離れると,別の原子の最外殻にある電子がそれを補います。これが常に起こっているため,原子どうしが離れずに結びついているのです。自由電子が金属原子を結びつける結合を金属結合といいます。
また,金属結合によってできた結晶を,金属結晶といいます。金属元素だけで構成されている物質は,金属結晶に分類されます。
金属の塊では,多くの原子が金属結合により結びついています。例えば,1gの鉄Feには1022個の鉄原子が含まれています。しかし,Fe10000000000000000000000とは書きません。金属もイオン結晶と同じように,組成式でFeと表します。
スポンサーリンク
金属の性質
金属には次のような特徴があります。
- 電気や熱をよく導く。
- 展性や延性がある。
- 金属光沢がある。
- 典型金属の融点は低く,遷移金属の融点は高い。
これらの性質は,自由電子で説明することができます。
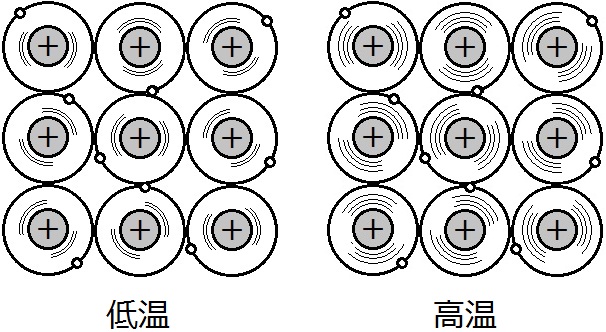
金属の導電性や熱伝導性が高いのは,自由電子の移動によって電気や熱のエネルギーが運ばれるからです。ちなみに,温度が高くなると,導電性は低くなります。これは,原子核の振動(熱運動)が激しくなって自由電子の移動が妨げられるからです。
金属に展性や延性があるのは,原子が金属結合により結びつけられているからです。外から力を加えたとき,イオン結晶では正負の電荷による反発力が働きましたが,金属結合ではどの原子も同じように働くので金属結合は残ります。
金属光沢は,自由電子によって光が反射されるために見られます。自由電子が非常に速く移動しており,原子核の間の空間を埋めているのです。ほとんどの金属では,すべての波長の光が反射されるので銀白色です。しかし,金Auと銅Cuは一部の波長の光を吸収するので,黄金色や赤銅色の光沢を示します。
金属の融点は,金属結合の強さに影響されます。また,金属結合は,自由電子が多いほど強くなります。詳しいところまで覚える必要はありませんが,遷移金属の原子では最外殻だけではなく内側の電子殻に配置されている電子も自由電子として働くのです。よって,遷移金属は金属結合が強いために融点が高く,典型金属の融点は低い傾向にあります。
スポンサーリンク