「物質量と気体の体積」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 物質量と化学反応式 > 物質量と気体の体積
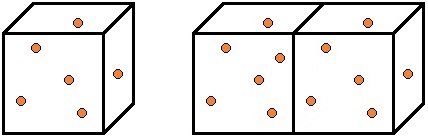
アボガドロの法則
アボガドロの法則は,1811年にアメデオ・アボガドロ(イタリア)が提唱した「同温・同圧のもとで同じ体積の気体には,気体の種類によらず,同数の分子が含まれている」という法則です。
この法則を別の視点で考えると,「温度・圧力・分子の数(物質量)が同じなら,気体の種類が違っても,同じ体積になる」ということも言えます。
つまり,ヘリウムHe(分子量4.0)でも塩素Cl2(分子量71)でも,温度・圧力・分子の数(物質量)が同じなら,同じ体積になるのです。
スポンサーリンク
物質量と気体の体積
通常,気体について考えるときは標準状態(1013hPa,0℃)で考えます。標準状態で1molの気体の体積を調べると,気体の種類によらず,22.4Lになるという実験結果が得られました。
また,物質量が2倍,3倍,・・・・・・となると,気体の体積も2倍,3倍,・・・・・・となることから,物質量〔mol〕と気体の体積〔L〕は比例関係だということがわかります。
気体の物質量をn〔mol〕,標準状態における気体の体積をV〔L〕とおくと,
1mol : 22.4L = n〔mol〕 : V〔L〕
よって,V = 22.4 × n , n = 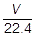
また,1molあたりの気体の体積〔L〕をL/molという単位で考えることができ,これをモル体積〔L/mol〕といいます。標準状態における気体のモル体積は,気体の種類によらず,22.4L/molです。
モル体積〔L/mol〕は,単位に注目しながら式を立てるときに有効です。
L/mol は分数で表すと 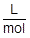 となります。
となります。
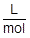 × mol = L より,モル体積〔L/mol〕に物質量〔mol〕を掛けることで,質量〔L〕を求めることができます(V = 22.4 × n)。
× mol = L より,モル体積〔L/mol〕に物質量〔mol〕を掛けることで,質量〔L〕を求めることができます(V = 22.4 × n)。
L ÷ 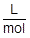 = mol より,体積〔L〕をモル質量〔L/mol〕で割ることによって,物質量〔mol〕を求めることができます(n =
= mol より,体積〔L〕をモル質量〔L/mol〕で割ることによって,物質量〔mol〕を求めることができます(n = 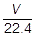 )。
)。
気体の平均分子量(見かけの分子量)
空気のように,複数の気体が均一に混ざったものを混合気体といいます。2種類以上の気体を同じ容器に入れると,時間がたつにつれて均一になっていくのです(上方置換や下方置換で気体を捕集するときは短時間なのでほとんど混ざっていません)。
物質は純物質と混合物に分類されるので,混合気体を1つの物質として考えることができます。このときの分子量を,「平均分子量」または「見かけの分子量」とよんでいます。
前ページで,分子量は1molあたりの質量〔g〕と同じ値になることを確認しました。これは気体の場合にも成り立ちます。
たとえば,乾燥空気を窒素N2が80%,酸素O2が20%の混合気体だと考えます。アボガドロの法則により,この混合気体を22.4L集めれば,合計1molの気体分子が含まれているはずです。その質量〔g〕を求めれば,同じ値である分子量を求めたことになります。
この混合気体1mol中には,窒素0.8mol(1molの80%)と酸素0.2mol(1molの20%)が含まれています。
窒素N2(分子量28)0.8molの質量・・・ 28g/mol × 0.8mol = 22.4g
酸素O2(分子量32)0.2molの質量・・・ 32g/mol × 0.2mol = 6.4g
混合気体1molの質量・・・ 22.4g + 6.4g = 28.8g
よって,乾燥空気の平均分子量は28.8というように求めることができます。
気体の密度
固体や液体の密度は,1cm3あたりの質量〔g〕なので,「g/cm3」の単位で表されます。しかし,気体は固体や液体に比べて密度が小さいので,1cm3あたりの質量では値も小さくなり扱いづらくなってしまいます。そのため,気体の密度は,1Lあたりの質量〔g〕を考えて「g/L」の単位で表されます。
標準状態において,気体1molの体積は22.4Lです。また,分子量Mの気体1molの質量はM〔g〕です。つまり,標準状態において,分子量Mの気体は,22.4LでM〔g〕です。
これまでに,物質量〔mol〕と質量〔g〕は比例関係であることと,物質量〔mol〕と気体の体積〔L〕は比例関係であることを学びました。つまり,物質量〔mol〕が2倍になれば質量〔g〕も体積〔L〕も2倍になり,物質量〔mol〕が半分になれば質量〔g〕も体積〔L〕も半分になるのです。
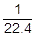 molの気体を考えれば,標準状態における気体の体積は22.4mol/L×
molの気体を考えれば,標準状態における気体の体積は22.4mol/L×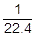 mol=1Lです。また,その質量はM〔g/mol〕×
mol=1Lです。また,その質量はM〔g/mol〕×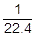 mol=
mol=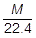 〔g〕です。1Lあたりの質量が
〔g〕です。1Lあたりの質量が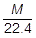 〔g〕なので,分子量Mの気体の標準状態における密度は,
〔g〕なので,分子量Mの気体の標準状態における密度は,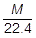 〔g/L〕です。
〔g/L〕です。
これは,分子量が大きいほど密度も大きいことを意味しています。そのため,気体の密度の大小関係は,分子量の大小関係を比較すればわかるのです。
たとえば,水素H2(分子量2.0)は乾燥空気(平均分子量28.8)よりも密度が小さく,塩素Cl2(分子量71)は乾燥空気よりも密度が大きいということがわかります。
スポンサーリンク