「化学反応式と量的関係」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 物質量と化学反応式 > 化学反応式と量的関係
化学反応式と物質量の関係
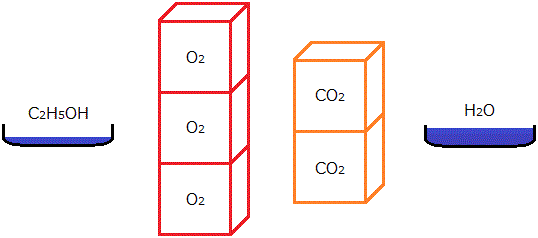
化学反応式の係数は,分子などの粒子の数の比を表しています。例えば,エタノールの完全燃焼は次の化学反応式で表されます。
C2H5OH + 3O2 → 2CO2 + 3H2O
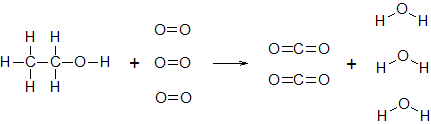
このとき,エタノール1分子と酸素3分子が反応して,二酸化炭素2分子と水3分子が生成します。もちろん,エタノール2分子(さっきの2倍)が反応するならば酸素は6分子(さっきの2倍)が必要ですし,二酸化炭素は4分子(さっきの2倍),水は6分子(さっきの2倍)が生成します。
エタノールの完全燃焼において,最も簡単な整数比に直したときの1:3:2:3という数の比は変わることがありません。
化学において,粒子の数を表す「物質量〔mol〕」で考えても,1molのエタノールが完全燃焼するためには酸素3molが必要です。また,このとき二酸化炭素2molと水3molが生成します。つまり,化学反応式の係数の比は,物質量〔mol〕の比ということができます。
この関係は,計算問題に応用されます。
どれか1つの物質について物質量〔mol〕が求められれば,残りの物質についても反応に関わった物質量〔mol〕が求められるということです。ただ,反応で消費されて減少するのか,生成して増加するのかには気を付けてください。
例えば,1.5molのエタノールが完全燃焼したとします。このとき,酸素は1.5mol×3=4.5molが反応したことがわかります。また,二酸化炭素は1.5mol×2=3.0mol,水は1.5mol×3=4.5molが生成したことがわかります。
| C2H5OH | + | 3O2 | → | 2CO2 | + | 3H2O | |
| 変化量 | 1.5mol減少 | 4.5mol減少 | 3.0mol増加 | 4.5mol増加 | |||
| 比 | 1 | : | 3 | : | 2 | : | 3 |
スポンサーリンク
化学反応式と質量の関係
前項で,化学反応式と物質量の関係から,反応に関わる物質の物質量〔mol〕を求めることができることを確認しました。
また,以前に分子量・式量と物質量〔mol〕から質量〔g〕を求める方法を確認しました(原子量・分子量・式量と質量)。これを基に,エタノール1.5molの完全燃焼における質量〔g〕の関係を確認します。
C2H5OH + 3O2 → 2CO2 + 3H2O
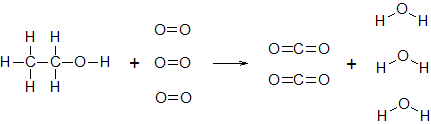
- エタノールの分子量C2H5OH=46より,46g/mol×1.5mol=69g
- 酸素の分子量O2=32より,32g/mol×4.5mol=144g
- 二酸化炭素の分子量CO2=44より,44g/mol×3.0mol=132g
- 水の分子量H2O=18より,18g/mol×4.5mol=81g
| C2H5OH | + | 3O2 | → | 2CO2 | + | 3H2O | |
| 変化量 | 69g減少 | 144g減少 | 132g増加 | 81g増加 | |||
| 比 | 分子量×1 | : | 分子量×3 | : | 分子量×2 | : | 分子量×3 |
それぞれの物質の分子量は異なりますので,質量〔g〕の関係を考えるとき,基本的には簡単な比とはなりません。化学反応式の係数から物質量〔mol〕を求め,そこから質量〔g〕を求めるべきでしょう。
化学反応式の係数の比は物質量〔mol〕の比,つまり粒子の数の比を表しています。物質が違えば,1個当たりの質量〔g〕も違います。そのため,係数の比と質量〔g〕の比が同じにならないのです。
化学反応式と気体の体積の関係
物質量〔mol〕の比から,標準状態における気体の体積の比を考えます。
物質量〔mol〕から気体の体積〔L〕を求める方法も確認済みです(物質量と気体の体積)。これを基に,エタノール1.5molの完全燃焼における気体の体積〔L〕の関係を確認します。
C2H5OH + 3O2 → 2CO2 + 3H2O
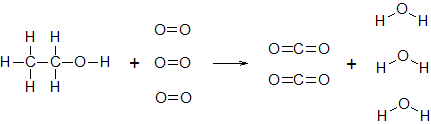
- エタノールは標準状態で液体なので,省略
- 酸素の体積=22.4L/mol×4.5mol=100.8L
- 二酸化炭素の体積=22.4L/mol×3.0mol=67.2L
- 水は標準状態で液体なので,省略
| C2H5OH | + | 3O2 | → | 2CO2 | + | 3H2O | |
| 変化量 | ― | 100.8L減少 | 67.2L増加 | ― | |||
| 比 | ― | : | 3 | : | 2 | : | ― |
気体の物質量〔mol〕と標準状態における体積〔L〕の関係は,物質の種類に関係なく22.4L/molです。そのため,気体の体積〔L〕の比は,化学反応式の係数の比と等しくなります。
ただし,標準状態ですべて気体として存在している物質の間でしか,この関係は成り立ちません。
スポンサーリンク