「酸化剤と還元剤」のページです。
高校化学Net参考書 ~化学基礎~
高校化学Net参考書 > 「化学基礎」 > 酸化還元反応 > 酸化剤と還元剤
酸化剤と還元剤
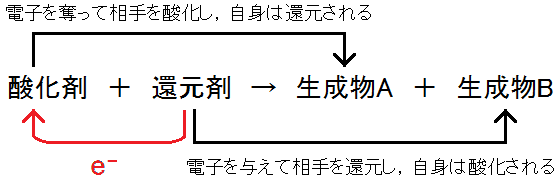
酸化還元反応において,相手を酸化した物質を酸化剤とよんでいます。
酸化剤は,相手の電子e-を奪うことで,相手を電気的に正の方へと変化させます。これは,相手の酸化数を増加させて酸化したことになります。
このとき,酸化剤として働いた物質は必ず電子e-を受け取っているので,酸化数は減少して還元されたことになります。
また,酸化還元反応において,相手を還元した物質を還元剤とよんでいます。
還元剤は,相手に電子e-を与えることで,相手を電気的に負の方へと変化させます。これは,相手の酸化数を減少させて還元したことになります。
このとき,還元剤として働いた物質は必ず電子e-を失っているので,酸化数は増加して酸化されたことになります。
酸化還元の定義のページで説明したように,酸化反応と還元反応は同時に起こるので酸化還元反応とよばれます。よって,酸化還元反応においては,必ず酸化剤と還元剤が存在します。
スポンサーリンク
電子e-を含むイオン反応式(半反応式)
酸化還元反応の化学反応式は,複雑なものが多くあります。たとえば,銅と希硝酸の反応などは,未定係数法の問題としてよく出題されています。
aCu + bHNO3 → cCu(NO3)2 + dH2O + eNO
⇒ 3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
このような複雑な反応も,酸化反応と還元反応に分けて考えることができます。
基本的に,酸化剤や還元剤として働きやすい物質は決まっています。また,反応後にどのような物質やイオンになるのかも決まっています。
表 主な酸化剤・還元剤と半反応式(過マンガン酸カリウムのK+など,反応前後で変化していないイオンは,半反応式では省略されます。)
| 酸化剤 | 半反応式 |
|---|---|
| 過マンガン酸カリウムKMnO4 (酸性) | MnO4- + 8H+ + 5e- → Mn2+ + 4H2O |
| 過マンガン酸カリウムKMnO4 (中性・塩基性) | MnO4- + 2H2O + 3e- → MnO2 + 4OH- |
| 濃硝酸HNO3 | HNO3 + H+ + e- → NO2 + H2O |
| 希硝酸HNO3 | HNO3 + 3H+ + 3e- → NO + 2H2O |
| 熱濃硫酸H2SO4 | H2SO4 + 2H+ + 2e- → SO2 + 2H2O |
| 二クロム酸カリウムK2Cr2O7 | Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O |
| 塩素などのハロゲン | Cl2 + 2e- → 2Cl- |
| オゾンO3(酸性) | O3 + 2H+ + 2e- → O2 + H2O |
| オゾンO3(中性・塩基性) | O3 + H2O + 2e- → O2 + 2OH- |
| 過酸化水素H2O2 | H2O2 + 2H+ + 2e- → 2H2O |
| 二酸化硫黄SO2 | SO2 + 4H+ + 4e- → S + 2H2O |
| 還元剤 | 半反応式 |
| シュウ酸(COOH)2 | (COOH)2 → 2CO2 + 2H+ + 2e- |
| 硫化水素H2S | H2S → S + 2H+ + 2e- |
| 塩化スズ(Ⅱ)SnCl2 | Sn2+ → Sn4+ + 2e- |
| 硫酸鉄(Ⅱ)FeSO4 | Fe2+ → Fe3+ + e- |
| ヨウ化カリウムなどの ハロゲン化水素 | 2I- → I2 + 2e- |
| ナトリウムなどの金属 | Na → Na+ + e- |
| チオ硫酸ナトリウムNa2S2O3 | 2S2O32- → S4O62- + 2e- |
| 過酸化水素H2O2 | H2O2 → O2 + 2H+ + 2e- |
| 二酸化硫黄SO2 | SO2 + 2H2O → SO42- + 4H+ + 2e- |
水H2O,水素イオンH+,電子e-は,以下のようにして加えることになりますので,それ以外の物質やイオンだけを暗記すれば十分です。覚えるべきところは,上の表で赤字にしておきました。酸性条件での過マンガン酸カリウムを例にしながら,半反応式のつくり方を紹介します。
- 暗記した物質やイオンを書く。
例: MnO4- → Mn2+ - 酸素原子の少ない方にH2Oを加えて,数を合わせる。
例: MnO4- → Mn2+ + 4H2O - 水素原子の少ない方にH+を加えて,数を合わせる。
例: MnO4- + 8H+ → Mn2+ + 4H2O - 電荷の大きい方に,負の電荷をもつ電子e-を加えて,電荷を等しくする。
例: MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
ちなみに,2~4を逆にする方法もあります。酸化数の変化から,必要分だけ電子e-を加え,電荷をH+で合わせたあと,水素原子の数をH2Oで合わせるという方法です。酸素原子の数は,自動的に合うようになっています。
例: MnO4- → Mn2+ (酸化数+7→+2なので,左辺に5e-を加える)
MnO4- + 5e- → Mn2+
MnO4- + 5e- + 8H+ → Mn2+
MnO4- + 5e- + 8H+ → Mn2+ + 4H2O
酸化還元反応のイオン反応式
先述のように,酸化反応と還元反応は同時に起こっています。還元剤から酸化剤へと電子が移動することで酸化還元反応がおこるのです。
よって,酸化剤の半反応式と還元剤の半反応式を組み合わせることで,酸化還元反応が完成します。このとき,酸化剤が受け取る電子e-の数と還元剤が与える電子e-の数が等しくなるようにしてから足し合わせます。
例として,過マンガン酸カリウム(硫酸を加えて酸性にした水溶液)と過酸化水素の酸化還元反応について,イオン反応式をつくっていきます。まず,それぞれの半反応式を示します。
(酸化剤)MnO4- + 5e- + 8H+ → Mn2+ + 4H2O
(還元剤)H2O2 → O2 + 2H+ + 2e-
ここで,過マンガン酸カリウムの酸化剤としての半反応式を2倍,過酸化水素の還元剤としての半反応式を5倍すると,電子e-の係数が最小公倍数の10で等しくなります。
(酸化剤)2MnO4- + 10e- + 16H+ → 2Mn2+ + 8H2O
(還元剤)5H2O2 → 5O2 + 10H+ + 10e-
5molの過酸化水素が10molの電子を渡し,2molの過マンガン酸カリウムが10molの電子を受け取ったことになります。これを一つの式にまとめると,次のようになります。
2MnO4- + 10e- + 16H+ + 5H2O2
→ 2Mn2+ + 8H2O + 5O2 + 10H+ + 10e-
これを整理すると,酸化還元反応のイオン反応式が次のように完成します。
2MnO4- + 6H+ + 5H2O2 → 2Mn2+ + 8H2O + 5O2
酸化還元反応の化学反応式
主な酸化剤・還元剤と半反応式の表のところで書いたように,反応前後で変化していないイオンは省略されています。
省略されたイオンを補って,イオン式のない状態にしたものを「化学反応式」とします。一般的には,通常の反応式や半反応式,イオン反応式などを総称して化学反応式というのですが,酸化還元反応の分野では習慣として区別することになります。
イオン反応式で省略されているイオンを補って化学反応式にするときには,左辺のイオンから考えます。
たとえば,過マンガン酸カリウム(硫酸を加えて酸性にした水溶液)と過酸化水素の酸化還元反応のイオン反応式ではMnO4-,H+というイオンが左辺にあります。
2MnO4- + 6H+ + 5H2O2 → 2Mn2+ + 8H2O + 5O2
MnO4-は,過マンガン酸カリウムKMnO4から生じたものです。次式から,MnO4-と同じ物質量のK+が省略されていることが分かります。
KMnO4 → K+ + MnO4-
(2MnO4-を生じるためには,2KMnO4 → 2K+ + 2MnO4-)
また,硫酸を加えて酸性にした(硫酸酸性といいます)ことから,H+の半分の物質量のSO42-が省略されていることが分かります。
H2SO4 → 2H+ + SO42-
(6H+を生じるためには,3H2SO4 → 6H+ + 3SO42-)
よって,先ほどのイオン反応式では,2K+と3SO42-が省略されていたことが分かります。また,これらのイオンは反応前後で変化しないために省略されていたので,反応後にも同じだけ残っているはずです。そこで,省略されていた2K+と3SO42-を両辺に戻します。
2MnO4- + 6H+ + 5H2O2 + 2K+ + 3SO42-
→ 2Mn2+ + 8H2O + 5O2 + 2K+ + 3SO42-
さらに,電気的に中性(電荷がプラスマイナスゼロ)になるように陽イオンと陰イオンを組み合わせると,イオン式の書かれていない「化学反応式」をつくることができます。
2KMnO4 + 3H2SO4 + 5H2O2
→ 2MnSO4 + 8H2O + 5O2 + K2SO4
スポンサーリンク