化学基礎の「中和滴定曲線」の実験について,分かりやすく解説しているNet参考書です。
高校化学Net参考書 ~実験指針書「化学基礎」~
高校化学Net参考書 > 実験指針書「化学基礎」 > 中和滴定曲線
「中和滴定曲線」の実験の目的
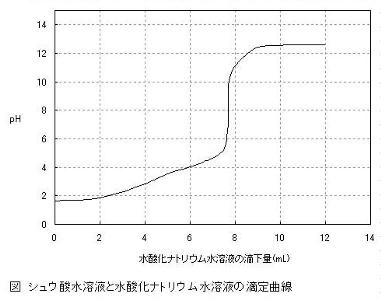
指示薬を用いるのではなく,pHを測定しながら中和滴定を行ってグラフを書き,pHジャンプから中和点を求める実験です。弱酸と弱塩基の水溶液だと指示薬で中和点を求めることができませんが,中和滴定曲線を書くと中和点を求めることができます。また,二価の酸・塩基が1つずつH+やOH-を出すようすなどに気付くことができます。応用次第で,様々な学習効果が期待できますので,生徒の状況に合わせて実験を組み立ててみてください。
準備
- 器具の準備
- 全体
- 試薬ごとのビーカー
- 廃液バケツ
- 班ごと
- 250mL-洗びん×1(蒸留水用)
- 100mL-ビーカー×2(酸の水溶液用,塩基の水溶液用)
- スタンド×1
- アーム×2(ビュレットを上下2ヶ所で固定)
- ビュレット×1
- ろうと×1
- 300mL-ビーカー(廃液用)
- 10mL-ホールピペット×1
- 100mL-コニカルビーカー×1
- pHメーター×1
- 試薬の準備
- 0.10mol/L希塩酸
- 0.10mol/L酢酸水溶液
- 0.10mol/Lシュウ酸水溶液
- 0.10mol/L希硫酸
- 0.10mol/Lリン酸水溶液
- 0.10mol/L水酸化ナトリウム水溶液
- 0.10mol/Lアンモニア水
- 0.10mol/L水酸化バリウム水溶液
- 0.10mol/L炭酸ナトリウム水溶液
- その他,任意の酸・塩基の水溶液
実験操作
- 塩基の水溶液でビュレットを共洗いしてから,塩基の水溶液を満たす(ろうとを用いる)。コックより先には水溶液が入っていないので,廃液ビーカーに勢いよく流すことで先端まで溶液を満たす。
- 酸の水溶液10mLを,ホールピペットを用いてコニカルビーカーに量り入れる。ホールピペットは酸の水溶液で共洗いしておく。コニカルビーカーは蒸留水で洗っておき,濡れたまま使用してもいい。
- コニカルビーカーにpHメーターの電極部を浸し,滴下量ごとのpHを記録する。
(中和点付近では,少量ずつ滴下する。1滴ずつでも構わない。)
グラフ自動作成ファイル&手書き用グラフ用紙(エクセルファイル)のダウンロード - 水溶液の種類を変える場合は,ホールピペットやビュレットの他に,班ごとに取り分けるためのビーカーも共洗いする。
注意点
- 希硫酸やアンモニア水など,取り扱いに注意が必要な水溶液もあります。衣類や皮膚につかないように注意しましょう。
- pHメーターのガラス電極は,衝撃に対して非常に弱いです。マグネチックスターラーで撹拌する場合は,破損に注意しましょう。
- pHメーターのガラス電極は,乾燥に対して非常に弱いです。使用後は,保存液に浸した状態で保管しましょう。
スポンサーリンク